Допплерография перинатальных поражений головного мозга, 1999
Е.А. Зубарева, И.В. Дворяковский, А.Р. Зубарев, А.Б. Сугак
Предисловие
В книге освещены нормальная ультразвуковая анатомия основных структур головного мозга новорожденного ребенка, технология ультразвукового исследования головного мозга у детей и особенности применения допплеровских методик, рассмотрены артериальная и венозная системы кровоснабжения мозга и параметры допплеровской кривой мозгового кровотока, оптимальные подходы для обнаружения мозговых сосудов. Большое внимание уделено изменениям мозгового кровотока, связанным с ростом и развитием ребенка, изменениям при перинатальных поражениях головного мозга и в раннем восстановительном периоде перинатальной энцефалопатии, изменениям при инфекциях и воздействии различных лекарственных средств.
Для акушеров, перинатологов, неврологов, педиатров.
Авторский коллектив монографии
Зубарева Елена Анатольевна — кандидат медицинских наук, доцент кафедры ультразвуковой диагностики Российской медицинской академии последипломного образования МЗ РФ.
Дворяковский Игорь Вячеславович — доктор медицинских наук, профессор, заведующий отделением ультразвуковой и рентгеновской диагностики НИИ педиатрии Научного центра здоровья детей РАМН.
Зубарев Андрей Русланович — кандидат медицинских наук, заведующий отделом ультразвуковой диагностики Медицинского центра гражданской авиации.
Сугак Анна Борисовна — кандидат медицинских наук, научный сотрудник отделения недоношенных детей НИИ педиатрии Научного центра здоровья детей РАМН.
Оглавление
Глава 1. Методика и нормальная ультразвуковая анатомия головного мозга
1.1. Методика нейросонографии
1.2. Методика допплерографии
1.3. Используемые допплеровские системы
1.4. Параметры допплеровской кривой мозгового кровотока
1.5. Нормальная ультразвуковая анатомия основных структур головного мозга новорожденного ребенка
1.5.1. Костные структуры
1.5.2. Извилины и борозды
1.5.3. Мозолистое тело
1.5.4. Желудочки мозга
1.5.5. Цистерны мозга
1.5.6. Полость прозрачной перегородки и полость Верге
1.5.7. Мозжечок
1.5.8. Паренхима мозга
1.5.9. Герминальный матрикс
1.5.10. Кровоснабжение головного мозга
1.5.11. Оптимальные подходы для обнаружения мозговых сосудов
Глава 2. Изменения мозгового кровотока, связанные с ростом и развитием ребенка
Глава 3. Изменения мозгового кровотока при перинатальных поражениях головного мозга
3.1. Мозговой кровоток в остром периоде перинатальных поражений мозга
3.2. Изменения мозгового кровотока в раннем восстановительном периоде перинатальной энцефалопатии
Глава 4. Изменения мозгового кровотока при инфекциях
Глава 5. Состояние центральной и церебральной гемодинамики у новорожденных детей с перинатальной энцефалопатией
Глава 6. Влияние на мозговой кровоток различных лекарственных средств
1. Методика и нормальная ультразвуковая анатомия головного мозга
1.1. Методика нейросонографии
Для проведения ультразвукового исследования головного мозга у новорожденных и детей раннего возраста необходимо использование высокочастотных секторных и микроконвексных датчиков частотой 5,0 и/или 7,0 МГц. Специальной медикаментозной подготовки и анестезии не требуется. Сканирование мозга у детей, которые находятся в тяжелом состоянии, проводят в кувезах, палатах и боксах, где находится ребенок. При необходимости им проводится инфузионная терапия, искусственная вентиляция легких. Тяжесть состояния не является противопоказанием для проведения нейросонографии (НСГ) (рис. 1).
Рис. 1. Осмотр глубоко недоношенного ребенка в отделении реанимации.
Основные показания к проведению НСГ:
- гестационный возраст менее 36 нед, масса тела менее 2800 г;
- клинические признаки поражения ЦНС;
- ухудшение состояния;
- множественные стигмы дисэмбриогенеза;
- указание в анамнезе на хроническую внутриутробную гипоксию, асфиксию в родах, синдром дыхательных расстройств, инфекционные заболевания у матери и ребенка.
Исследование проводят в коронарной и сагиттальной плоскостях, путем изменения наклона датчика вперед-назад, вправо-влево для последовательного получения структур правого и левого полушарий. При необходимости (в редких случаях) проводят сканирование в аксиальной плоскости для более четкой визуализации срединных структур и некоторых сосудов мозга (рис. 2).
Рис. 2. Плоскости сканирования и схемы сечений в них: а — через лобные доли; б — через передние рога боковых желудочков; в — через межжелудочковое отверстие (Монро) и III желудочек; г — через тела боковых желудочков; д — через треугольник бокового желудочка; е — через затылочные доли мозга; ж — срединное сагиттальное сечение; з — парасагиттальное сечение через каудоталамическую вырезку; и — парасагиттальное сечение через боковой желудочек; к — парасагиттальное сечение через рейлев островок; л — на уровне ножек мозга; м — в проекции III желудочка и зрительных бугров; н — на уровне тел боковых желудочков.
1.2. Методика допплерографии
Физическая основа метода — эффект Допплера: частота ультразвуковых волн, отраженных от движущегося объекта, изменяется на величину, пропорциональную скорости движения объекта (в данном случае форменных элементов крови). Когда известен угол инсонации (угол между испускаемым ультразвуковым лучом и исследуемым сосудом) и измерено смещение частоты (разница между испускаемой и отраженной частотой), скорость кровотока может быть вычислена по формуле
v=CΔf/(2focosα),
где С — скорость звуковых волн в ткани мозга (1540 м/ с); Δf — изменение частоты испускаемого УЗ-луча; f0 — излучаемая частота; α — угол между УЗ-лучом и исследуемым сосудом.
При малых углах инсонации (меньше 15°) потенциальная погрешность при определении скорости мозгового кровотока мала, но при больших углах точное количественное измерение этого угла становится необходимым, так как погрешность значительно возрастает.
1.3. Используемые допплеровские системы
Спектральная допплеровская эхография (спектральный допплер, D-режим) — оценка спектра скоростей кровотока в сосудах в процессе его изменения во времени.
Ранние исследования мозгового кровотока у новорожденных осуществлялись допплеровскими приборами непрерывного излучения (CW — continuous wave), при использовании которых все движущиеся структуры, попавшие в ультразвуковой луч, независимо от глубины расположения производят изменение частоты отраженного луча, поэтому данный метод характеризуется невысоким пространственным разрешением. Датчики непрерывного излучения испускают и получают ультразвук в непрерывном режиме благодаря тому, что один кристалл является излучателем, а другой — в этом же датчике приемником отраженных сигналов. Это наиболее простые из допплеровских приборов. В настоящее время отдельно они практически не применяются, а метод оценки скорости (средней и максимальной) используется как один из режимов в более совершенных приборах спектральной допплерографии. В приборах «слепого» допплера необходимо хорошее знание расположения сосудов для направления ультразвукового луча на интересующий сосуд и отсечения всех других сосудов, находящихся рядом.
Основным недостатком метода CW-допплера является отсутствие разрешающей способности по глубине. Это возможно в методе импульсноволнового допплера (pulse wave Doppler — PW). Импульсные сигналы дают возможность наблюдать отдельные участки по глубине, как и при исследовании в В-режиме. При этом чем более короткий импульс излучения используют, тем большую точность определения глубины достигают. Ультразвуковые сканеры, в которых наряду с В-режимом применяют спектральный допплер (D-режим), носят название дуплексных приборов. Режим, отображающий на экране сканера одновременно В- и D-эхограммы, называют дуплексным режимом (В+D), а само исследование — дуплексным (рис. 3). При этом датчик ультразвукового прибора является как излучателем, так и приемником отраженного сигнала. Использование таких систем позволяет в получаемом срезе мозга определить локализацию сосуда благодаря его пульсации, а вид сосуда — знанию анатомии. Таким образом, имея на экране картину сосуда, в его просвет вводят объемный маркер (контрольный объем), что позволяет получать допплеровскую кривую и оценить спектр скоростей кровотока в искомом сосуде. Контрольный объем (строб) определяет по глубине ширину интервала, в котором оценивается спектр кровотока в режиме PW. При проведении исследования в данном режиме следует пользоваться допплеровскими фильтрами, которые служат для подавления эхо-сигналов от пульсирующих стенок сосудов. Однако недостатком исследования в черно-белом режиме являются значительные затруднения в поиске сосудов, особенно у детей первых дней жизни, и тем более родившихся раньше срока.
Рис. 3 и 4. Дуплексное и триплексное сканирование.
Системы цветового допплеровского картирования — ЦДК (CFM — color flow mapping), представляющие следующий этап в развитии ультразвуковой техники, позволяют легко обнаружить сосуд и получить информацию об относительном направлении и скорости кровотока, кодированную цветом. При ЦДК получаем «слепок» просвета сосуда. Допплеровская информация, получаемая при этом методе, как правило, воспроизводится на экране прибора совместно с двухмерным полутоновым изображением для совместной оценки морфологии исследуемого сосуда, геометрии потоков и их функциональных характеристик. Одновременное формирование в режиме реального времени полутонового двухмерного изображения, информации ЦДК в выбранной двухмерной области и спектрограммы потока в зоне установленного строба получило название триплексного режима (рис. 4). В большинстве приборов направление потока к датчику кодируется красным цветом, а от датчика — синим; более высокая скорость обозначается более насыщенным цветом. При этом изменения цвета от темно-красного до красного, оранжевого и желтого отображают возрастающую величину среднего значения скорости для прямого кровотока. Для обратного кровотока в зависимости от величины сдвига цвет меняется от темно-фиолетового до голубого, иногда зелено-голубого. Таким образом, при исследовании через большой родничок большинство артерий мозга выглядят красными или желтыми, а вены — синими. Системы цветовой допплерографии позволяют выбрать оптимальную пози-цию для размещения объемного маркера в крупных мозговых артериях для измерения скорости мозгового кровотока с минимальной погрешностью, а также получить изображение глубоких вен.
Более точная оценка васкуляризации может быть получена при использовании модификации цветового допплеровского картирования по энергии — ЦДКЭ (CDE — color Doppler energy), при котором цветное изображение сосуда получается в результате регистрации самого факта движения в точке пространства (наличия допплеровского сдвига частот) и подсчитывания энергии отраженных сигналов. Преимущество энергетической допплерографии — независимость от угла инсонации, а также от скорости и направления потока, что повышает чувствительность и разрешающую способность метода. Использование таких приборов позволяет исследовать микроциркуляцию в наиболее функционально важных отделах мозга новорожденного, изучать сосуды с низкой скоростью кровотока и малым диаметром, более точно оценивать степень васкуляризации. Так, например, с помощью ЦДКЭ на новейших разработках фирмы «Дженерал Электрик» LOGIC 500 и LOGIC 700 возможно выявить сосуды в области герминального матрикса, оценить кровоток в стриарных артериях (рис. 5).
Рис. 5. ЦДКЭ в стриарных артериях области головки хвостатого ядра (а) и таламуса (б).
Кроме того, в приборах высокого класса (high-end) на цветном мониторе обычное серошкальное изображение может быть представлено окрашенным в один из цветов, а также возможен выбор цветовых карт энергетического картирования. Это не дает дополнительной информации, но облегчает восприятие изображения, подчеркивая контраст или создавая ощущение большей четкости и объемности (рис. 6).
Рис. 6. Карты цветного картирования (а-д).
В системах высшего класса имеется режим получения трехмерной энергетической допплерографии, или трехмерной ультразвуковой ангиографии (spatial flow, 3D). В приборе запоминаются последовательные кадры изображения, полученные в различных ракурсах при медленном наклоне датчика, не нарушая его контакта с телом пациента. В устройстве обработки прибора реконструируется трехмерное изображение только цветной части эхограммы, характеризующей кровоток в сосудах. Это трехмерное изображение сосудов можно поворачивать и наблюдать с различных сторон. Данный метод не позволяет отображать информацию о скоростях кровотока в сосудах, так же как и двухмерный энергетический допплер. Он регистрирует только факт наличия кровотока. Однако, меняя ракурс наблюдения, поворачивая трехмерное изображение сосудов, возможно получить достаточно полное представление о пространственном расположении и форме сосудов, что дает дополнительную диагностическую информацию (рис. 7). Несмотря на некоторые сложности при проведении исследования (отсутствие опыта у врача, состояние пациента), метод является перспективным, что обуславливает его дальнейшее развитие и широкое применение в педиатрической практике.
Рис. 7. Трехмерная реконструкция сосудов: передней мозговой артерии (а), виллизиева круга (б), стриарных артерий (в).
1.4. Параметры допплеровской кривой мозгового кровотока
Допплеровский спектр — частотный спектр эхо-сигналов от движущихся элементов. Допплеровская кривая скорости мозгового кровотока графически — это линия, очерчивающая верхний контур спектрограммы кровотока. Поток крови в артериях мозга пульсирует в соответствии с фазами сердечного цикла — с подъемом во время систолы и падением во время диастолы. Так как сосудистое ложе головного мозга является системой с низкой резистентностью, в силу его внутричерепного расположения и высоких метаболических потребностей в мозговых артериях отмечается постоянный поступательный кровоток, в том числе и во время диастолы.
Спектрограмма венозного мозгового кровотока имеет линейный вид, однако во многих центральных венозных каналах в норме отмечается низкоамплитудная пульсация, связанная, вероятно, с изменениями внутригрудного давления и с сотрясениями правого желудочка при сердечных сокращениях.
Состояние кровотока оценивают как по качественным, так и по количественным характеристикам. К качественным характеристикам относят характер звукового допплеровского сигнала, форму допплерограммы, направление кровотока. Вид допплерограммы позволяет оценить состояние кровотока, поскольку при его нарушениях форма спектра претерпевает существенные изменения. Так, на допплерограмме может наблюдаться увеличение максимальной и снижение минимальной скоростей, изменение формы волны потока крови (ретроградный, флюктуирующий кровоток). При количественной оценке кривых скоростей кровотока наиболее часто используются следующие показатели допплеровской кривой:
- Vmax — максимальная систолическая скорость;
- Vmean — средняя скорость кровотока в течение сердечного цикла;
- Vmin — минимальная, диастолическая скорость.
Однако необходимо помнить, что указанные параметры зависят от угла наклона датчика по отношению к направлению кровотока. На практике наклон датчика выбирают таким образом, чтобы получить максимальную насыщенность спектра. Далее это значение угла используют при расчете вышеуказанных параметров. В современных приборах производится автоматическая коррекция наиболее рационального угла.
Для получения количественных параметров кровотока, не зависящих от угла наклона датчика, широко применяют специальные индексы:
- резистентности, ИР = (Vmax — Vmin)/Vmax (Pourcelot, 1975);
- пульсации, ИП = (Vmax — Vmin)/vmean (Gosling, 1974);
- систоло-диастолический — отношение систолической и диастолической скоростей кровотока, Vmax/Vmean (Stuart index).
В неонатологии наиболее употребим индекс резистентности (ИР). С некоторыми ограничениями он отражает степень резистентности (сопротивления) току крови части сосудистого дерева, лежащей дистальнее места исследования: высокий индекс коррелирует с повышенной резистентностью сосудов мозга и снижением скоростей кровотока, низкий — со снижением резистентности и повышением скоростей кровотока.
Для обеспечения стандартных условий проведения допплеровского исследования необходимо придерживаться следующих правил.
1. Исследования проводить при условии сохранения покоя новорожденного (в состоянии физиологического сна через 1-1,5 ч после кормления) с сохранением оптимальной температуры тела (в своих кроватках или кувезах) и режима вентиляции.
2. Использовать минимальный фильтр для устранения низкочастотных сигналов, производимых пульсовыми движениями стенок сосудов.
3. Исследование проводить при минимальных значениях угла инсонации исследуемого сосуда и контрольного допплеровского объема.
4. Выбирать наиболее протяженные участки сосуда без близко расположенных ветвлений его для сохранения ламинарного потока крови.
1.5. Нормальная ультразвуковая анатомия основных структур головного мозга новорожденного ребенка
Учитывая, что ультразвуковая анатомия головного мозга подробно описывалась отечественными и зарубежными авторами, в данной главе дана лишь основная характеристика видимых и наиболее значимых структур мозга.
1.5.1. Костные структуры
В коронарной плоскости сканирования видны три черепные ямки: передняя, средняя, задняя. Латеральные края передней черепной ямки представлены лобной и височной костями, а также решетчатыми костями, которые снаружи образуют ее основание. Видны структуры, образующие орбиты.
Средняя черепная ямка образована краями теменных костей, в средней части — крыловидными костями. Боковые края образованы теменной костью, отделены друг от друга сзади затылочной костью и лямбдовидным швом.
В задней черепной ямке ее латеральные края образуют теменные кости, которые отделены от затылочной лямбдовидным швом. Внизу она отграничена эхогенными линиями от намета мозжечка. Все костные образования представлены яркими, гиперэхогенными образованиями.
В сагиттальной плоскости срединный срез ограничен лобными костями, а также крыловидной костью, которая образует передний край передней черепной ямки с турецким седлом. Задняя черепная ямка ограничена затылочной костью.
В парасагиттальных сечениях основание средней черепной ямки состоит из каменистой части височной кости.
1.5.2. Извилины и борозды
Межполушарная щель просматривается во всех сечениях коронарной плоскости в различных своих отделах и представлена гиперэхогенной линейной структурой с отходящими от нее мелкими бороздками. Асимметричность отхождения бороздок может свидетельствовать о возможной аномалии развития и редко бывает вариантом строения.
Количество и степень выраженности борозд зависит от гестационного возраста ребенка. В наших исследованиях наиболее часто у детей в 22-23 нед гестации выявлялись теменно-затылочная и шпорная борозды, с 26 нед — нерегулярная тонкая поясничная борозда без выраженных изгибов, в 27-28 нед — обонятельная борозда, в 28-29 нед — короткая и длинная борозды рейлева островка, верхняя височная, в 34-35 нед — борозда передних отделов верхней лобной извилины, в 36 нед — задние отделы верхней лобной извилины.
Следует отметить, что визуализация структур островкового комплекса также зависит от зрелости новорожденного ребенка. У глубоко недоношенных детей (26 нед) он остается открытым и представлен в виде треугольника, флага, как структура повышенной эхогенности без определения в нем борозд. Закрытие сильвиевой борозды происходит по мере формирования лобной, теменной, затылочной долей, и полное закрытие рейлева островка с четкой сильвиевой бороздой и сосудистыми образованиями в ней заканчивается к 40-й неделе (рис. 8).
Рис. 8. Сильвиева борозда в области рейлева островка в В-режиме (а) и режиме ЦДКЭ с пульсацией средней мозговой артерии.
1.5.3. Мозолистое тело
Мозолистое тело состоит из валика, колена и ствола. Определяется при любом гестационном возрасте ребенка. При его исследовании важны не его размеры (длина составляет 35-50 мм), а четкость структуры его отделов. Варианты гипоплазии вплоть до полной агенезии встречаются при аномалиях развития мозга.
1.5.4. Желудочки мозга
Рис. 9. Схема желудочковой системы в коронарной (а) и сагиттальной (б) плоскостях: 1 — передний рог бокового желудочка, 2 — височный рог, 3 — затылочный рог, 4 — тело бокового желудочку, 5 — III желудочек, 6 — IV желудочек, 7 — отверстие Монро, 8 — сильвиев водопровод, 9 — отверстие Мажанди, 10 — отверстие Люшка.
В правом и левом полушариях определяются боковые желудочки (I и II), в промежуточном мозге III желудочек (рис. 9, 10). В среднем мозге полость превращается в узкий канал — водопровод мозга (сильвиев), соединяющий между собой III и IV желудочки. IV желудочек верхушкой вдается в червь мозжечка. На эхограммах они представлены анэхогенными образованиями, поскольку желудочки заполнены ликвором. Каждый боковой желудочек состоит из переднего, височного, затылочного рогов и тела. Передний рог расположен в лобной доле. Его нижняя боковая стенка окружает головку хвостатого ядра. Затылочный рог расположен в затылочной доле. Височный рог загибается вокруг таламуса вниз и далее вперед в височной доле. Тело бокового желудочка, его треугольник расположены на уровне соединения рогов. До пятого месяца внутриутробного развития все полости представляют собой замкнутую систему, что способствует развитию физиологической гидроцефалии. Только на пятом-шестом месяце внутриутробной жизни образуются отверстия Мажанди и Люшка и ликвор попадает на наружную поверхность мозга (в субарахноидальное пространство). Наиболее уязвимыми местами при нарушениях циркуляции ликвора являются водопровод мозга и монроевы отверстия, соединяющие боковые желудочки. В норме эти две структуры не видны.
Рис. 10. Эхограммы бокового желудочка в сагиттальной (а) и коронарной (б-г) плоскостях: 1 — передний рог, 2 — затылочный рог, 3 — височный рог, 4 — тело бокового желудочка, 5 — III желудочек, 6 — сосудистое сплетение, 7 — хвостатое ядро, 8 — полость прозрачной перегородки, 9 — таламус, 10 — поясная борозда, 11 — межполушарная щель, 12 — мозолистое тело, 13 — сильвиева борозда, 14 — мозжечок.
Оценка размеров различных отделов желудочковой системы необходима для исключения вентрикулярной дилатации (вентрикуломегалии) вследствие кровоизлияния, ишемии, инфекции, атрофии мозга. Авторами предложен целый ряд методик для измерения желудочков. Наиболее стабильными, по нашим данным, являются размеры тела (глубина не более 4 мм) и его переднего рога (глубина 1-2 мм). Затылочный рог часто асимметричен, вариабелен по глубине и своим размерам. Размеры III желудочка составляют 2-4 мм. Оценка IV желудочка затруднительна, поэтому обращают внимание на его форму и структуру, которые могут значительно меняться при аномалиях развития мозга.
Вентрикуломегалия может быть транзиторная, персистирующая, нарастающая до внутренней гидроцефалии. С помощью НСГ можно выявить уровень окклюзии (сильвиев водопровод в 60%, монроевы отверстия в 25%, отверстия Люшка и Мажанди в 10%, субарахноидальное пространство в 5%). Условно различают:
1) начальные признаки расширения желудочковой системы, проявляющиеся увеличением глубины тел боковых желудочков до 5-8 мм, исчезновением бокового искривления и появлением округлой формы тел боковых желудочков. Может отмечаться расширение затылочных рогов боковых желудочков. III и IV желудочки не расширены;
2) умеренная вентрикуломегалия характеризуется увеличением глубины тел до 9 мм, небольшим равномерным расширением всех отделов боковых желудочков, III желудочек увеличен до 4-6 мм, IV желудочек, как правило, в норме;
3) выраженная вентрикуломегалия сопровождается увеличением глубины более 9 мм, расширением III желудочка (появление межталамической перегородки в его полости) и IV желудочка, расширением цистерн мозга (рис. 11).
Рис. 11. Варианты вентрикуломегалии: а — начальная, б — умеренная, в — выраженная.
В области тела и затылочного рога бокового желудочка определяется гиперэхогенное сосудистое (хориоидальное) сплетение, основная функция которого вырабатывать спинномозговую жидкость (ликвор). Оно лежит на основании бокового желудочка, имеет полукруглую форму, с ровными контурами. Наиболее широкая часть его определяется на уровне тела и затылочного рога, где можно увидеть его утолщение — сосудистый клубочек (glomus). Далее сосудистое сплетение через отверстие Монро входит в III желудочек. Таким образом, оно не доходит до переднего рога бокового желудочка и, следовательно, не может быть визуализировано в этом отделе. Это представляется важным при наличии тромба в переднем роге и возможном принятии его за нормальную анатомическую структуру. Сосудистые сплетения могут быть причиной внутрижелудочковых кровоизлияний у доношенных детей (рис. 12). Если оно незначительное, то может явиться чисто ультразвуковой находкой, а в дальнейшем быть причиной развития кист сосудистого сплетения. Однако эти кисты могут возникать и внутриутробно после специфической инфекции и являться стигмами дисэмбриогенеза и маркерами хромосомных нарушений (рис. 13).
Рис. 12 и 13. Кровоизлияние в сплетение. Асимметрия сплетений (а) и тромб на сплетении (б). Множественные кисты сосудистого сплетения.
1.5.5. Цистерны мозга
Цистерны мозга — пространства между мозговыми оболочками. Под мозжечком и продолговатым мозгом расположена мозжечково-мозговая цистерна (cisterna cerebello medulallis или cisterna Magna), между ножками мозга — межножковая цистерна (cisterna interpeduncularis), между перекрестом зрительных нервов и лобными долями мозга — цистерна перекреста (cisterna chiasmatis) и др. Из всех цистерн наиболее важна большая цистерна (рис. 14). Размеры ее колеблются от 2-3 до 10-12 мм. Многие аномалии развития задней черепной ямки отражаются на ее строении (киста Денди-Уокера, гипоплазия мозжечка, ретромозжечковая киста, опухоли мозжечка). Квадригеминальная цистерна обычно представлена эхогенной линией между III желудочком и червем мозжечка, толщина ее не более 3 мм. Она может увеличиваться при субарахноидальных кровоизлияниях и при кистах этой цистерны, которые сложно дифференцировать с арахноидальной кистой в этой области (рис. 15).
Pис. 14 и 15. Большая цистерна мозга и методика ее измерения. Киста квадригеминальной цистерны.
1.5.6. Полость прозрачной перегородки и полость Верге
Полость прозрачной перегородки и полость Верге являются срединными эмбриональными структурами, которые определяются у недоношенных детей. Отмечена прямо пропорциональная зависимость их выявления на эхограммах от гестационного возраста. Размеры полости прозрачной перегородки могут варьировать от 2 до 10 мм. Обе полости не сообщаются с желудочковой системой, а их разделение сводом мозга носит условный характер (рис. 16). При патологии (внутренняя гидроцефалия, отек мозга) они могут видоизменяться (фенестрация полости прозрачной перегородки) и разрушаться (рис. 17).
Рис. 16. Полость прозрачной перегородки (а) и полость Верге (б).
Рис. 17. Сужение (а) и фенестрации (б) полости прозрачной перегородки при выраженной вентрикуломегалии.
1.5.7. Мозжечок
Его полушария являются гипоэхогенными структурами, расположенными в задней черепной ямке. Червь мозжечка гиперэхогенный и виден в сагиттальной плоскости позади моста и IV желудочка, тогда как полушария — в парасагиттальных.
Ствол мозга, мост расположены в сагиттальной плоскости кпереди от мозжечка.
1.5.8. Паренхима мозга
Паренхима мозга представлена двумя полушариями средней эхогенности. Вокруг боковых желудочков, преимущественно затылочных рогов и нередко передних рогов, у недоношенных детей выявляется ореол повышенной эхогенности, размер и визуализация которого зависят от гестационного возраста, он может сохраняться до 2-3 нед жизни после рождения. При его эхогенности, превышающей таковую сосудистого сплетения, следует проводить ультразвуковое исследование в динамике (1 раз в неделю), поскольку этот признак указывает на ишемическое поражение и возможность развития перивентрикулярных псевдокист. Асимметрия перивентрикулярного ореола может свидетельствовать в пользу кровоизлияния или участка менингоэнцефалита. В обоих случаях это является показанием для допплеровского исследования сосудов мозга.
В толще белого вещества полушарий мозга, латеральнее и несколько внизу от боковых желудочков, выделяются по своей эхогенности зрительные и базальные ядра (рис. 18).
Рис. 18 и 19. Схема расположении зрительных и базальных ядер в сагиттальной плоскости: 1 — хвостатое ядро, 2 — таламус, 3 — чечевицеобразное ядро, 4 внутренняя капсула. Стеноз на уровне сильвиева водопровода. Межталамическая перегородка в просвете расширенного 3 желудочка
Зрительные ядра (таламусы) представлены двумя овоидными структурами, расположенными по бокам от полости прозрачной перегородки и III желудочка. Они соединены между собой межталамической перегородкой, но разделены III желудочком. Межталамическая перегородка (massa intermedia) становится четко видимой при расширении III желудочка в виде гиперэхогенной точечной структуры (рис. 19). Их боковые края прилежат к внутренней капсуле. На эхограммах они видны в виде неравномерной прерывистой структуры относительно низкой эхогенности.
Базальные ядра (чечевицеобразное, хвостатое, миндалевидное тело, ограда) расположены между зрительным ядром и рейлевым островком. Имеют одинаковую эхогенность, что затрудняет их дифференцировку. Их визуализация возможна при использовании датчика 10 МГц. При патологии ядер (кровоизлияние, ишемия) данные образования приобретают повышенную эхогенность типичной локализации (рис. 20).
Рис. 20. Эхограмма области базальных ядер в норме (а) и при их ишемии (б).
Хвостатое ядро расположено в сером веществе, под нижне-латеральной стенкой бокового желудочка, и состоит из головки, тела и хвоста. На эхограмме видна его головка в виде овальной структуры средней эхогенности, расположенной кпереди от отверстия Монро, ниже переднего рога бокового желудочка. Тело расположено кзади вдоль таламуса и дна бокового желудочка. Хвост лежит в крыше височного рога. Между зрительным и чечевицеобразным ядрами находится каудоталамическая вырезка, визуализация которой важна при диагностике субэпендимального кровоизлияния.
1.5.9. Герминальный матрикс
Герминальный матрикс (герминативный, зародышевый, ГМ) — источник пери-интравентрикулярных кровоизлияний (ПВК). Находится между хвостатым ядром и нижней стенкой бокового желудочка в каудоталамической вырезке. ГМ представлен эмбриональной тканью с высокой метаболической и фибринолитической активностью. Отвечает за продукцию глиобластов, которые мигрируют в течение второго триместра беременности в паренхиму и базальные ядра и впоследствии становятся мозговой олигодендроглией и астроцитами. ГМ имеет широкую сеть малодифференцированных хрупких сосудов, стенки которых состоят из одного слоя эндотелия, лишены коллагеновых и эластичных волокон и по строению могут рассматриваться как капилляры.
Ширина ГМ находится в обратно пропорциональной зависимости от срока гестации плода. Его наибольшая активность отмечается между 24-34 нед, затем он подвергается постепенной инволюции и исчезает к моменту рождения. Поэтому практически исключено развитие перивентрикулярных кровоизлияний у детей, рожденных в срок. Процесс этот происходит неравномерно: сначала ГМ исчезает в области IV желудочка, затем III желудочка и затылочных рогов боковых желудочков. У плодов со сроком гестации 34-36 нед выявляют участки фетальной ткани в области передних рогов боковых желудочков. Таким образом, у недоношенных и незрелых новорожденных процесс регрессии ГМ заканчивается после рождения. Этим объясняется частота и топография перивентрикулярных кровоизлияний. Кровоизлияния могут быть ограничены в герминальном матриксе рядом с головкой хвостатого ядра (ПВК 1 степени), но чаще прорываются в полость бокового желудочка (ПВК 2 степени), расширяя его (ПВК 3 степени), и сочетаются со вторичной ишемией, венозным застоем в перивентрикулярной области (ПВК 4 степени). Кровоизлияния сами по себе могут приводить к ишемии вследствие реактивного вазоспазма и сдавливающего эффекта. Стойкая гипотензия может привести к ишемии. Попытки врачей в это время улучшить состояние ребенка путем коррекции ацидоза, гипогликемии и/или гиперкапнии приводят к резкому повышению мозгового кровотока, что, в свою очередь, из-за несовершенства и нарушения ауторегуляции механизмов мозгового кровотока и высокой фибринолитической активности сосудов ГМ приводит к развитию ПВК, и таким образом возникает геморрагически-ишемическое повреждение головного мозга (сочетание перивентрикулярного кровоизлияния и перивентрикулярной лейкомаляции).
У детей со сроком гестации не более 32 нед при повторном ультразвуковом сканировании на третьей-четвертой неделе жизни нередко выявляются участки повышенной эхогенности, симметрично с двух сторон в области монроевых отверстий. Они могут быть ошибочно приняты за ПВК 1 степени. Следует помнить, что регресс герминального матрикса у глубоко недоношенных детей продолжается и после рождения, а сочетание его с хронической внутриутробной гипоксией этой области приводит к образованию нередко симметричных гиперэхогенных участков ишемии. В динамике образуются псевдокисты, которые в отличие от субэпендимальных кровоизлияний чаще множественные и более вытянутой формы (рис. 21). Иногда этот процесс называют субэпендимальным герминолизисом.
Рис. 21. Субэпендимальные уплотнения (а, б) и псевдокисты (в, г) у ребенка с ГВ 30 нед (субэпендимальный герминолизис).
1.5.10. Кровоснабжение головного мозга
Артериальная система мозга. Снабжение головного мозга кровью осуществляется 4 артериями: двумя внутренними сонными (а. carotis interna) и двумя позвоночными (a. vertebralis). Левая сонная артерия отходит непосредственно от дуги аорты. После прохождения в полость черепа через синус внутренние сонные артерии делятся на переднюю и среднюю мозговые артерии (a. cerebri anterior и a. cerebri media). Позвоночные артерии при вхождении в полость черепа сливаются на основании мозга в один общий сосуд — основную артерию (a. basilaris). Пройдя некоторое расстояние, она делится на две задние мозговые артерии (a. cerebri posterior). Отходящие от них сосуды соединяются с a. carotis interna. Две передние мозговые артерии соединяются между собой передней соединительной артерией (a. communicans anterior). А две средние и задние — посредством a. communicans posterior. Таким образом, на основании мозга располагается непрерывный сосудистый канал, получивший название артериального круга большого мозга — виллизиева (circulus arteriosus Willisii). Основной функцией этого сосудистого образования является четкое обеспечение мозговой циркуляции. Каждая мозговая артерия имеет определенное анатомическое расположение. При поражении какой-либо артерии в четко определенных областях мозга на эхограммах отмечают появление эхогенных структур, что свидетельствует о нарушении мозгового кровообращения в соседних областях мозга (рис. 22а).
Рис. 22. Схема артерий основания мозга (а, в) и вен (б, г): 1 — передняя мозговая артерия, 2 — передняя соединительная артерия, 3 — внутренняя сонная артерия, 4 — средняя мозговая артерия, 5 — задняя соединительная артерия, 6 — задняя мозговая артерия, 7 — базилярная артерия, 8 — позвоночная артерия, 9 — вена Галена, 10 — поперечный синус, 11 — прямой синус, 12 — нижний сагиттальный синус, 13 — таламостриарная вена.
Венозную систему мозга принято делить на группу поверхностных и группу глубоких вен. Поверхностные вены отводят кровь от серого и белого вещества головного мозга. Глубокие вены собирают кровь от подкорковых образований. Густая сеть поверхностных вен образуется в результате восходящих внутримозговых и радиарных вен мозга. Парные внутренние мозговые вены, соединяясь, образуют крупную v. cerebri magna (вену Галена), которая отводит кровь от зрительного бугра, аммонова рога, от белого вещества вокруг мозолистого тела. Особенность венозной системы мозга в том, что мозговые вены непосредственно переходят в венозные синусы. Самый крупный — непарный верхний продольный (сагиттальный) синус (sinus sagittalis superior); он впадает в заднюю часть латерального синуса (sinus lateralis), далее переходит в сигмовидный синус (sinus sigmoideus) и, пройдя яремное отверстие (foramen jugularis), переходят во внутренние яремные вены (v. jugularis interna). Нижний продольный синус (sinus longitudinalis inferior или sinus sagitalis inferior) впадает в прямой синус (sinus rectus). В него впадают вена Галена и верхняя мозговая вена, отводящие кровь от базальных ганглиев, желудочков и сосудистых сплетений. В кавернозный синус (sinus cavernosus) впадают вены глазницы, средняя и нижняя мозговые вены. Этот синус соединен с каменистым синусом (sinus petrosus superior et inferior), по ним венозная кровь оттекает во внутреннюю яремную вену (рис. 22б).
1.5.11. Оптимальные подходы для обнаружения мозговых сосудов
Допплерографическое исследование кровотока проводят в наиболее крупных магистральных артериях головного мозга: внутренней сонной, передней, средней, базилярной, задней и стриарных артериях. Исследование с помощью цветового допплеровского картирования, особенно в режиме ЦДКЭ, значительно упрощает поиск и визуализацию артерий.
Внутренняя сонная артерия (ВСА). Допплеровские системы цветового изображения позволяют почти полностью увидеть ее ход в сагиттальной плоскости. Для снятия показателей используют вертикальную часть артерии после ее выхода из каротидного канала над уровнем турецкого седла. Далее, над уровнем переднего клиновидного отростка, внутренняя сонная артерия делится на переднюю и среднюю мозговые артерии. При исследовании с помощью дуплексной черно-белой допплерографии проще идентифицировать внутреннюю сонную артерию в коронарной плоскости через турецкое седло (рис. 23а).
Рис. 23. Триплексное сканирование внутренней сонной (а), передней мозговой (б, в), средней (г), базилярной (д) и стриарной (е) артерий.
Передняя мозговая артерия (ПМА) является ветвью внутренней сонной артерии. Самая удобная и простая позиция для ее обнаружения — срединный сагиттальный срез через большой родничок (рис. 23б). Для получения показателей кровотока объемный маркер устанавливают перед коленом мозолистого тела или в проксимальной части артерии перед ее изгибом вокруг этой структуры. При этом угол между осью сосуда и ультразвуковым лучом минимальный. Обычно правая и левая передние мозговые артерии расположены очень близко друг к другу, анастомозируя между собой, что не позволяет их различить как отдельные сосуды. Их можно увидеть отдельно, применяя технологию цветового допплеровского картирования по энергии (рис. 24). Исследовать кровоток в передней мозговой артерии также возможно в коронарной плоскости, сразу над местом сближения тел боковых желудочков (рис. 24).
Рис. 24. ЦДКЭ позволяет увидеть две передние мозговые артерии и место их анастомоза.
Средняя мозговая артерия (СМА) — самая крупная ветвь внутренней сонной артерии. Основным ориентиром в поиске артерии служит сильвиева борозда (на границе лобной и височной долей), где расположена эта артерия (рис. 23г). Наиболее удачный угол ее инсонации достигается при аксиальном подходе — через височную кость над наружным слуховым проходом, в 8-10 мм по направлению к глазнице.
Современные высокочувствительные приборы позволяют с помощью ЦДКЭ и трехмерной реконструкции сосудов определить кровоток в стриарных артериях (СА), которые являются ветвями средней мозговой и направлены вверх к таламусу и головке хвостатого ядра, обеспечивая кровоснабжение герминального матрикса в каудо-таламической вырезке. Визуализация этих артерий представляет интерес, поскольку у недоношенных детей в этой области определяются линейные участки уплотнения в форме «трезубца» (парасагиттальные ветви) при внутриутробной инфекции, ишемических нарушениях (рис. 25). Данные изменения могут отмечаться у новорожденных детей с внутриутробным гепатитом и гепатоспленомегалией. Допплеровские методики подтверждают сосудистый характер происхождения этих уплотнений. Скоростные параметры, как правило, не отличаются от нормативных.
Рис. 25. Схема (а) и эхограммы ветвей (б) стриарной артерии: 1 — хвостатое ядро, 2 — таламус, 3 — стриарная артерия, 4 — средняя мозговая артерия.
Базилярную артерию (БА) удобно обследовать в срединном сагиттальном срезе на передней поверхности моста или в коронарной плоскости в нескольких миллиметрах за местом обнаружения внутренней сонной артерии (рис. 23д). На уровне ножек мозга непарная базилярная артерия делится на две задние мозговые артерии. Оценка кровотока в ней наиболее доступна в аксиальной плоскости. При ЦДКЭ возможна визуализация задней мозговой артерии, отходящей от базилярной.
Асимметрии показателей кровотока в магистральных артериях правого и левого полушарий головного мозга у новорожденных в норме не выявляется.
Используя современные аппараты цветового допплеровского картирования, в энергетическом режиме в коронарной плоскости можно получить полную картину всего виллизиева круга, включая средние мозговые артерии, задние соединительные артерии, задние мозговые артерии и проксимальные части обеих передних мозговых артерий (рис. 7г, 26а, 26б). В аксиальной плоскости при транскраниальном исследовании четко видны сосуды виллизиева круга, место деления базилярной артерии на задние мозговые артерии.
Рис. 26. ЦДКЭ (а) и трехмерная реконструкция (б) сосудов виллизиева круга.
При проведении допплерографического обследования необходимо помнить, что в строении сосудистой системы мозга имеются большие индивидуальные различия. По данным патологоанатомов, среди здоровых людей классическое строение виллизиева круга встречается лишь в 20% случаев (рис. 27). У остальных выявляется гипоплазия, асимметрия в размерах и ветвлениях, незамкнутый виллизиев круг.
Рис. 27. Варианты строения виллизиева круга.
Оценка сосудов, образующих виллизиев круг у новорожденных детей, в настоящее время актуальна, так как в последние годы у детей с выраженными дыхательными нарушениями применяется метод экстракорпоральной мембранной оксигенации (ЕСМО). При этом бедная кислородом кровь из правой внутренней яремной вены через катетер большого диаметра поступает в резервуар, где она насыщается кислородом, и затем также через катетер с помощью насоса подается в правую сонную артерию. После окончания процедуры и удаления катетеров сосуды временно перевязываются, и кровоснабжение мозга осуществляется за счет коллатералей. В случаях нарушения целостности или гипоплазии сосудов виллизиева круга, а также аномалий в системе венозного дренажа у ребенка могут развиться значительные неврологические осложнения после проведения ЕСМО. Этого можно избежать, проводя у новорожденных детей перед данной процедурой скрининг сосудов головного мозга с помощью энергетического допплера и трехмерной реконструкции сосудов.
Индивидуальные особенности расположения артерий мозга выражаются в разных вариантах их ветвления, взаиморасположения, в асимметрии и гипоплазии различных сосудов. Поэтому не существует нормативов абсолютных значений скоростей мозгового кровотока. Индивидуальные особенности расположения имеют и строение черепа, и размеры большого родничка — датчик можно поставить на передний или задний его угол, и тогда уже угол между УЗ-лучом и сосудом будет разный. Поэтому абсолютные скорости мозгового кровотока рекомендуется сравнивать в динамике у одного ребенка, полученные одним и тем же исследователем, на одном и том же приборе. И для толкования полученных данных исследователь должен опираться на свой собственный опыт работы на конкретном приборе. Более достоверными оказываются уголнезависимые показатели (ИР).
Мозговые вены. Хотя получение сигналов кровотока в крупных внутримозговых венозных коммуникациях новорожденных возможно и при использовании черно-белого дуплексного сканирования, цветовая допплерография значительно облегчает правильное обследование этих сосудов. Используя комбинации высокочастотных секторных датчиков и режимы ЦДК, можно визуализировать через большой родничок в сагиттальной плоскости под мозолистым телом вдоль крыши III желудочка две внутренние мозговые вены, сливающиеся в большую вену Галена (которая не всегда располагается строго срединно, а отклонена чаще вправо), далее по средней линии над мозжечком — прямой синус, сразу под костями черепа и под большим родничком — верхний сагиттальный синус. Реже удается обнаружить нижний сагиттальный синус и поперечные синусы. Также можно проследить внутреннюю яремную вену через большой родничок у ее входа в каротидный канал латеральнее от внутренней сонной артерии (рис. 28).
Рис. 28. Кровоток в вене Галена (а) и сагиттальном (ST) и прямом (SR) синусах (б). ЦДК.
Оценка кровотока у новорожденных детей проводится в вене Галена (ВГ). При обнаружении на эхограмме анэхогенной округлой структуры в месте расположения вены необходимо провести дифференциальную диагностику данного образования (аневризма вены Галена, арахноидальная киста, цистерна) с помощью импульсного, цветового или энергетического картирования для исключения артерио-венозной трансформации.
Арахноидальные кисты (АК) представляют собой одну из форм дизонтогенетических церебральных аномалий, развивающихся в большинстве случаев во внутриутробном периоде формирования дупликатуры паутинной оболочки. В кисте со временем накапливается ликвороподобная жидкость, что приводит к увеличению ее объема. Около 80% АК локализуется в структурах выше намета мозжечка, чаще по конвекситальной поверхности больших полушарий, в средней черепной ямке и супраселярном анатомическом регионе. Клинически АК проявляются лишь через несколько месяцев или даже лет после рождения. Ультразвуковыми признаками является округлой или овальной формы анэхогенное образование с четкими, ровными контурами, аваскулярное. АК, расположенная рядом с веной Галена, вызывает ее смещение (киста тенториальной вырезки) (рис. 29). Выявление в ней кровотока, особенно смешанного характера, требует исключения сосудистых мальформаций, прежде всего аневризмы вены Галена.
Рис. 29. Арахноидальная киста.
Аневризма вены Галена относится к артерио-венозным мальформациям сосудов головного мозга, наиболее часто выявляющимся у детей раннего возраста из класса всех сосудистых мальформаций. На НСГ определяется структура сниженной эхогенности позади III желудочка и различная степень окклюзионной гидроцефалии (рис. 30). При аневризме I типа (сочетание с большим количеством артерио-венозных коммуникаций), помимо нарушений церебральной гемодинамики, у детей отмечается тяжелая сердечная недостаточность, которая является причиной смерти в ранние сроки после рождения. При II типе (баллонообразное расширение большой мозговой вены в сочетании с небольшим количеством артерио-венозных шунтов) отмечают минимальные изменения (или их отсутствие) со стороны сердечной гемодинамики. Это наиболее доброкачественный тип (рис. 30). Важное значение в оценке аневризмы имеет ЦДКЭ, которое позволяет оценить расширение субэпендимальных сосудов, что является важным моментом при проведении шунтирующих операций. Импульсная допплерография позволяет дать оценку хирургического лечения и проводить дальнейшее катамнестическое наблюдение за больным.
Рис. 30. Аневризма вены Галена. Спектральная (а) доплерография и ЦДКЭ (б).
2. Изменения мозгового кровотока, связанные с ростом и развитием ребенка
В норме с увеличением гестационного и постнатального возраста, веса на протяжении первых месяцев жизни отмечается постепенное повышение максимальной, минимальной и средней скоростей в артериях, средней скорости в крупных мозговых венозных коллекторах и снижение индексов резистентности и пульсации. Причем наиболее выражена зависимость скоростей кровотока от массы тела. Наибольшие изменения происходят в первые 4 сут жизни, что связано с закрытием фетальных коммуникаций и постепенным снижением резистентности мозговых сосудов. Изучением допплерографических показателей мозгового кровотока у новорожденных детей занималось значительное количество отечественных и зарубежных авторов (табл. 1).
Таблица 1. Нормальные значения показателей мозгового кровотока у новорожденных по данным разных авторов (показатели скоростей даны в см/с)
Нормативные показатели мозгового кровотока выявлены на основании динамического исследования особенностей мозгового кровообращения у новорожденных детей на 1-7-е сутки жизни при неосложненном течении раннего неонатального периода у доношенных и «условно здоровых» недоношенных детей в зависимости от гестационного возраста. При этом основные показатели системной гемодинамики и газового состава крови, гематокрита находились в пределах нормативных показателей. На эхограммах при этом структурных изменений не обнаружено.
При исследовании качественных параметров кривых скоростей кровотока в основных магистральных артериях мозга у новорожденных контрольной группы установлено, что он имеет типичную для артермальных сосудов форму двухфазной кривой, отражающей пульсирующий характер кровотока. При этом в начале спектра выделяется фаза акселерации, характеризующая непрерывное быстрое повышение скорости кровотока в первой половине систолы, а затем фаза децелерации, представляющая замедление скорости кровотока от максимальной систолической до конечной диастолической. Выявлены характерные особенности кривых скоростей кровотока в зависимости от гестационного возраста и исследуемого сосуда. Так, у доношенных новорожденных форма кривых имеет более пологий вид с плавным замедлением скорости кровотока от максимальной систолической до конечной диастолической. Форма кривых скоростей кровотока имеет также отличительные специфические особенности в зависимости от исследуемого сосуда, что обусловлено, по-видимому, различным диаметром сосудов и анатомо-топографическими особенностями, обуславливающими различную эластичность их стенок.
В раннем неонатальном периоде кровоток в течение всего сердечного цикла сохраняется непрерывным. Диастолический компонент кровотока регистрируется во всех исследованных сосудах, хотя скорости диастолического кровотока сохраняются на относительно низком уровне. Также не выявляется ретроградный диастолический кровоток. Указанные свойства спектра допплерограммы свидетельствуют, что артериальные системы мозга относятся к системам с терминальным периферическим сопротивлением, обеспечивающим непрерывное кровоснабжение головного мозга.
Количественный анализ кривых скоростей кровотока проводится с тщательным учетом показателей системной гемодинамики и газового состава крови и последующим сравнительным анализом. Возбуждение ребенка, крик, гипервентиляция значительно меняют скоростные параметры кровотока.
Индекс резистентности (ИР) во всех изучаемых сосудах на первой неделе жизни снижается с увеличением возраста детей. Это обусловлено в основном повышением уровня диастолического кровотока, что свидетельствует об общем увеличении уровня мозгового кровотока в этот период жизни. К четвертому дню жизни ИР в бассейнах внутренней сонной и базилярной артерий остается достаточно стабильным и колеблется в пределах 0,64-0,68. Независимо от возраста ребенка отмечена закономерность: ИР крупных сосудов больше, чем их ветвей. Это характерно для базилярной артерии и ее ветвей — задних мозговых артерий; для внутренней сонной артерии и ее ветвей — передней и средней мозговых артерий (табл. 2).
Таблица 2. ИР в артериях мозга у детей при физиологическом течении неонатального периода
В бассейне внутренней сонной артерии и ее ветвей — передней и средней мозговых артерий отмечается достоверное увеличение сосудистой резистентности ко второму часу жизни, что свидетельствуют о снижении уровня мозгового кровотока в бассейне этих артерий. При этом кровоток в бассейне основной и задних мозговых артерий сохраняется стабильным. В возрасте 1 сут жизни происходит существенное изменение картины кровоснабжения головного мозга: снижается ИР всех исследуемых сосудов и, следовательно, возрастает уровень мозгового кровотока. Начиная с первых суток жизни сохраняется относительно стабильная картина кровоснабжения головного мозга: ИР различных артерий мозга колеблется в небольших пределах, и достоверных изменений ИР до четвертых суток не отмечается. Наиболее высокий ИР при рождении отмечен в бассейне базилярной артерии, что говорит о низком уровне кровоснабжения мозжечка, моста и продолговатого мозга. Наименьшие значения ИР отмечены для передней мозговой артерии, указывая на наиболее высокий уровень кровоснабжения лобных долей полушарий мозга. Промежуточные значения ИР отмечаются в средней мозговой артерии и задней мозговой артерии. Ко вторым суткам жизни происходит переход на новый уровень кровоснабжения головного мозга, отличающийся большей интенсивностью кровотока, при сохранении существовавших соотношений между кровоснабжением различных областей мозга новорожденных детей.
У недоношенных детей диастолическая скорость кровотока низкая и в первые дни может быть близка к нулю, соответственно и индекс резистентности у них выше, чем у доношенных. С ростом ребенка на протяжении первых месяцев жизни индексы снижаются, приближаясь к значениям доношенных детей. У условно здоровых недоношенных детей индексы резистентности крупных артерий (внутренняя сонная и базилярная артерии) имеют более высокие показатели, чем в более мелких ветвях (передняя и средняя мозговые и задняя мозговая артерия). В отличие от показателей ИР у доношенных детей, он у недоношенных во всех исследуемых сосудах имеет более высокие значения и вариабельность. Высокая резистентность мозговых артерий у недоношенных детей не только является результатом левоправого шунтирования крови через боталлов проток (что выявляется, однако, не у всех детей), но и отражает морфологические особенности сосудистой системы мозга на данном этапе развития. Бурный рост капиллярной сети, созревание нервных окончаний и гладкомышечных компонентов сосудистой стенки, которые и обеспечивают регуляцию просвета сосуда, начинается после 30-32 нед внутриутробного развития, а до этого все три слоя стенок внутримозговых сосудов отличаются значительной незрелостью в количественном и качественном отношении.
Это подтверждают проведенные нами исследования взаимосвязи показателей сердечного выброса и мозгового кровотока у недоношенных детей, находившихся в стабильном состоянии. Результаты показали наличие достоверной положительной зависимости между скоростями кровотока в передней мозговой и базилярной артериях и абсолютной величиной сердечного выброса у детей с гестационным возрастом менее 34 нед. То есть у таких детей способность к поддержанию постоянства мозгового кровотока независимо от изменений сердечного выброса (ауторегуляция) отсутствует или несовершенна на протяжении первых недель жизни. Поэтому у этих пациентов для раннего выявления отклонений, которые могут усугубить церебральную патологию, необходимо регулярно оценивать функциональные и морфометрические параметры сердца с помощью эхокардиографии.
При интерпретации данных допплерографии сосудов мозга необходимо учитывать не только вес, гестационный и постнатальный возраст ребенка, но и влияние таких факторов, как гематокрит, парциальное давление кислорода и углекислого газа, концентрация глюкозы в крови, объем циркулирующей крови, а также состояние центральной гемодинамики при некоторых пороках сердца. При полицитемии увеличивается вязкость и снижаются скорости кровотока, а индекс резистентности повышается; при низком гематокрите, выраженной анемии скорости кровотока повышаются. Углекислый газ является мощным вазодилататором — при гиперкапнии и выраженной гипоксии с ацидозом отмечается увеличение скоростей мозгового кровотока и снижение ИР. При гипогликемии, которая наблюдается после рождения у гипотрофичных детей, скорости мозгового кровотока повышены и медленно снижаются после введения глюкозы. Гемодинамически значимый открытый артериальный проток приводит к лево-правому шунтированию крови и обеднению потока к голове, что выражается в резком снижении диастолической скорости на допплерограмме (иногда может отмечаться даже ретроградный поток во время диастолы) и высоких значениях индекса резистентности (рис. 31). При коарктации аорты обнаруживают увеличение систолической и диастолической скоростей в мозговых артериях по сравнению с нормой.
Рис. 31. Ретроградный поток крови при открытом артериальном протоке.
В отличие от выявленной у здоровых доношенных новорожденных детей закономерности, у недоношенных новорожденных не происходит характерного повышения резистентности крупных артерий мозга ко второму часу жизни, т.е. сохраняется практически неизмененным уровень кровоснабжения головного мозга (соответствующий по значениям ИР аналогичным у здоровых доношенных детей в возрасте 2 ч жизни). Кроме того, не обнаружено также и последующего существенного снижения ИР к первым суткам жизни. Преимущественное кровоснабжение получают бассейны средней мозговой артерии, несколько меньше — передней мозговой артерии.
Таким образом, во всех исследованных группах ИР крупных артериальных сосудов (внутренняя сонная и базилярная артерии) имеют более высокие значения, чем ИР меньших по диаметру артерий (передняя, средняя, задняя мозговые артерии).
Величина ИР всех сосудов постепенно уменьшается с увеличением возраста новорожденных детей. К концу первых суток жизни осуществляется переход на новый стабильный уровень кровоснабжения мозга, характеризующийся преимущественным кровоснабжением в бассейне передней, средней и задней артерий и относительно низким уровнем кровотока в бассейне базилярной артерии.
Становление мозгового кровотока у «условно здоровых» недоношенных детей имеет свои особенности. Чем более недоношен ребенок и чем меньше у него вес, тем сильнее это отражается на конечной диастолической скорости кровотока, а следовательно и на ИР. Причиной этому, кроме низкой плотности капилляров в мозге, может быть небольшое количество эластических волокон в мозговых артериях у недоношенных детей. ИР в бассейне внутренней сонной артерии и ее ветвей имеет достоверно более высокие значения, свидетельствующие о меньшем уровне кровоснабжения соответствующих областей мозга. Характерно, что здесь не выявлено типичной для доношенных детей динамики изменений ИР в возрасте 2 ч и 1 сут жизни. ИР имеет большую вариабельность и постепенно снижается к четвертым суткам жизни, когда происходит относительная стабилизация кровоснабжения мозга. Для этой подгруппы новорожденных выявлена также высокая степень корреляции показателей мозгового кровотока с показателями системной гемодинамики и газового состава крови.
3. Изменения мозгового кровотока при перинатальных поражениях головного мозга
3.1. Мозговой кровоток в остром периоде перинатальных поражений мозга
У новорожденных, перенесших тяжелую асфиксию в перинатальном периоде, отмечаются более высокие значения скоростей мозгового кровотока и более низкие уровни индекса резистентности по сравнению со здоровыми детьми на протяжении первых четырех дней жизни. Одни авторы объясняют подобное снижение резистентности сосудов и увеличение мозгового кровотока компенсаторным ответом на снижение внутричерепного давления и сжатие вен вследствие отека мозга; другие — прямым воздействием гиперкапнии и ацидоза на мозговые сосуды, а также увеличением сердечного выброса в ответ на гипоксию; третьи — потерей ауторегуляции, что приводит к дилатации и параличу сосудов головного мозга в течение какого-то времени после асфиксии. Увеличение мозговой перфузии сильнее выражено у недоношенных детей, перенесших асфиксию, чем у доношенных в подобном состоянии.
Допплерографические исследования мозгового кровотока у группе детей, перенесших асфиксию в перинатальном периоде (острую интранатальную и хроническую внутриутробную гипоксию), имеют свои характерные особенности (табл. 3). У этих детей отмечается неврологическая симптоматика в виде нарушения мозгового кровообращения (НМК) I или I—II степени (в клинической картине преобладает синдром повышенной нервно-рефлекторной возбудимости) при легкой степени асфиксии. В клинической картине новорожденных, перенесших асфиксию средней тяжести, преобладает синдром угнетения ЦНС, и основным диагнозом является НМК II или II—III степени.
Таблица 3. ИР в артериях мозга у детей, перенесших асфиксию в перинатальном периоде
У новорожденных, перенесших тяжелую асфиксию, в первые сутки на эхограммах возможно наблюдать признаки отечности мозга: выраженное диффузное повышение эхогенности мозговой ткани, сужение просвета боковых желудочков, снижение пульсации сосудов мозга. У части детей на вторые-четвертые сутки нередко выявляются признаки кровоизлияния в сосудистое сплетение и ПВК разной степени тяжести. При этом показатели системной гемодинамики отличаются от нормативных (гипотензия).
В возрасте 30 мин жизни у таких детей наблюдается достоверное снижение резистентности базилярной артерии и ее ветви — задней мозговой артерии, а также внутренней сонной. При этом возрастает кровоснабжение соответствующих областей головного мозга: стволовых структур и задних отделов головного мозга. К концу первых суток жизни отмечается нормализация показателей резистентности внутренней сонной и передней мозговой артерий и, следовательно, усиление кровоснабжения соответствующих областей мозга. В возрасте 2 сут жизни вновь выявляется повышение резистентности передней мозговой артерии, сохраняющееся и на третьи сутки жизни, с последующей нормализацией в возрасте 4 сут. Также повышена резистентность базилярной артерии на вторые сутки жизни, резистентность средней, внутренней сонной артерий при этом в пределах нормативных. Таким образом, в возрасте 2 сут наблюдается относительное снижение кровотока стволовых структур, лобных долей полушарий мозга. На третьи сутки жизни усиливается кровоснабжение в бассейне задней мозговой и базилярной артерии (ИР базилярной артерии в пределах нормы). Сохраняется относительное снижение кровотока в бассейне передней мозговой артерии (ИР повышен). К четвертым суткам жизни наблюдается нормализация кровоснабжения по передней, средней мозговым артериям. Таким образом, у новорожденных, перенесших острую интранатальную асфиксию, нормализация кровоснабжения головного мозга происходит к четвертым суткам жизни.
У доношенных новорожденных детей, перенесших хроническую внутриутробную гипоксию (легкой и средней степени тяжести) сразу после рождения, на 30-й минуте жизни, регистрировалось снижение резистентности внутренней сонной артерии, при этом показатели резистентности других артерий не отличались достоверно от нормативных. Ко второму часу жизни происходило увеличение резистентности внутренней сонной артерии. Это свидетельствует об относительном преобладании кровоснабжения в регионе передней мозговой артерии над областью кровоснабжения задней мозговой артерии. В возрасте 1 сут вновь наблюдается снижение резистентности внутренней сонной артерии, при этом в отличие от 30-й минуты жизни отмечалось также возрастание ИР средней мозговой артерии. На вторые сутки вновь происходило изменение картины кровоснабжения мозга. Возрастали ИР внутренней сонной, передней мозговой и базилярной артерий. Отмечалась положительная коррелятивная связь ИР передней, средней и внутренней сонной артерии и артериального давления и раС02.
У недоношенных детей, перенесших хроническую гипоксию в перинатальном периоде, сразу после рождения отмечалось снижение ИР внутренней сонной артерии. Ко второму часу жизни резистентность этой артерии резко возрастала, превышая нормативные показатели. Индекс резистентности остальных артерий не отличался от нормативных. В возрасте 1 сут вновь снижалась резистентность внутренней сонной артерии. Подобный характер изменений следует трактовать, по-видимому, как тенденцию к нормализации кровоснабжения различных отделов мозга. Однако на вторые сутки жизни отмечается дальнейшее перераспределение мозгового кровотока: снижалась перфузия стволовых структур и лобных долей полушарий мозга. На это указывают повышенные ИР внутренней сонной, базилярной и передней мозговой артерий. К третьим суткам жизни кровоснабжение мозга практически нормализовывалось, хотя оставался повышенным ИР внутренней сонной артерии. На четвертые сутки жизни сохранялось нормальное соотношение в распределении кровотока в различных регионах мозга при повышенных показателях резистентности во внутренней сонной и базилярной мозговых артериях. В этот период жизни нормальное распределение кровотока достигалось за счет относительного снижения перфузии стволовых структур и задних отделов полушарий головного мозга.
Отдельный анализ нужен для детей, перенесших тяжелую асфиксию в перинатальном периоде, у которых на третьи-четвертые сутки отмечается развитие ПВК. Результаты допплерографических исследований у них свидетельствуют о наличии гиперперфузии головного мозга от момента родов до 4 сут жизни включительно. Так, уже на 30-й минуте жизни регистрируется значительное снижение резистентности практически всех сосудистых систем, сохраняющееся и даже прогрессирующее (умершие дети) в последующие сутки жизни. Вместе с тем необходимо отметить, что наличие изменчивого, флюктуирующего характера кривых скоростей кровотока не позволяет четко определить показатель ИР.
При кровоизлияниях и ишемических повреждениях мозга в результате гипоксии надежды неонатологов на то, что допплерография даст простое объяснение патогенеза этих состояний, к сожалению, не оправдались. Результаты соответствующих относительно многочисленных исследований противоречивы. Сроки наибольшего числа возникновений ПВК на первые-четвертые сутки жизни связаны с процессом созревания способности организма ребенка поддерживать и регулировать мозговой кровоток, несмотря на изменения системного артериального давления.
Заслуживает внимания такой признак, как флюктуирующий, нестабильный тип допплеровской кривой, когда от одного сердечного цикла к другому скорости кровотока значительно варьируют (рис. 32). Хотя у здоровых людей все биологические параметры организма в течение суток подвергаются колебаниям, у новорожденных в норме коэффициент вариации показателей мозгового кровотока не должен превышать 10%. Высокоамплитудные колебания кровенаполнения мозга уже несут патологический характер и могут привести к развитию перивентрикулярной лейкомаляции или ПВК. Последние исследования, проведенные на приборах с энергетическим допплером, показывают, что большее прогностическое значение имеют не изолированные колебания скорости, а колебания скорости в совокупности с колебаниями площади поперечного сечения мелких мозговых артерий.
Рис. 32. Флюктуирующий кровоток.
Вероятно, эти изменения отражают нарушения ауторегуляции мозгового кровотока. Д.А. Ходов и Л.Д. Мочалова (1981) установили, что у здоровых доношенных детей со вторых суток жизни кровообращение мозга не зависит от изменений центральной гемодинамики. Другие авторы, исследуя мозговой кровоток и артериальное давление у новорожденных, обнаружили положительные корреляции между этими показателями у доношенных детей, находившихся в критическом состоянии (после асфиксии, с тяжелым синдромом дыхательных расстройств), и у недоношенных детей с гестационным возрастом менее 32 нед и массой тела при рождении менее 1500 г. Авторы назвали это явление «срывом» или «поломкой» ауторегуляции, при которой мозговой кровоток пассивно следует за изменениями артериального давления, увеличивая риск развития кровоизлияний при гипертензии и ишемического повреждения при падении артериального давления. G. Jorch объясняет такое нарушение ауторегуляции у глубоко недоношенных детей тем, что они не достигают «предела ауторегуляции», т.е. нижняя граница артериального давления у таких новорожденных менее 50 мм рт. ст., и механизмы ауторегуляции «не работают» при таких низких значениях перфузии мозга.
У детей с ПВК I степени (субэпендимальная гематома) на эхограммах в каудоталамической вырезке определяется гиперэхогенный округлый участок. Изменения формы, размеров боковых желудочков при этом кровоизлиянии не отмечается. На 10-14-й день на эхограмме определяется субэпендимальная псевдокиста на месте гематомы (рис. 33). Анализ результатов центральной гемоликвородинамики у детей этой группы показывает, что в отличие от условно здоровых недоношенных детей к третьим суткам происходит кратковременное повышение сосудистого тонуса с постепенным его снижением и стабилизацией к пятым-седьмым суткам жизни.
Рис. 33. ПВК 1 степени. Субэпиндимальная гематома (а), псевдокиста (б), кровоток в передней мозговой артерии (в).
При ПВК II степени на эхограммах отмечается сглаженность каудоталамической вырезки и неравномерность контуров с увеличением размеров сосудистого сплетения за счет образования внутрижелудочкового тромба (рис. 34). Анализ результатов допплерограмм выявляет снижение ИР. Тонус мозговых артерий нарастает с четвертых суток и может оставаться повышенным на первой-второй неделе жизни. Показатели гемодинамики нормализуются к концу второй недели жизни и остаются стабильными. М.С. Ефимов отмечает, что, несмотря на изменения в артериальном кровотоке, кровоток в вене Галена остается в пределах нормы.
Рис. 34. ПВК 2 степени. Сглаженность каудатоталамической вырезки (а), кровоток в передней мозговой артерии (б), стриарной артерии (в), вене Галена (г).
При ПВК III степени на эхограммах отмечаются массивные внутрижелудочковые тромбы и расширение желудочковой системы различной степени (рис. 35). Тяжесть состояния детей с ПВК III степени обусловлена дыхательной недостаточностью (СДР), неврологической симптоматикой НМК III степени. До развития ПВК кровоток у таких детей, как правило, снижен. Его резкое нарастание после кровоизлияния связывают со спазмом мозговых артерий и развитием ишемии мозга (ИР 0,9±0,02), снижением перфузионного давления за счет увеличения внутричерепного давления; кровоток в вене Галена, как правило, снижен.
Рис. 35. ПВК 3 степени. Тромб в просвете расширенного желудочка (а, б), высокий ИР в передней мозговой артерии (в).
Установление факта снижения скоростей кровотока, особенно диастолической, при массивном внутрижелудочковом кровоизлиянии, высокие значения индексов резистентности мозговых артерий, флюктуирующий характер кровотока являются плохими прогностическими признаками — большинство таких детей погибают. Стабилизация показателей допплерограммы служит критерием эффективности проводимой терапии. Вероятнее всего, высокая резистентность сосудов после кровоизлияния вторична и является признаком серьезного отклонения в мозговой ткани, свидетельствуя о прогрессивном увеличении сосудистого сопротивления, нарастании отека и снижении перфузионного давления. При этом последовательно за короткий период времени происходят следующие изменения: снижение диастолической скорости до нуля, появление ретроградного потока в диастолу, снижение систолического потока и в конце отсутствие сигнала от кровотока в артерии. Это надежное неинвазивное подтверждение смерти мозга, и его можно использовать наряду с другими методами для решения вопроса о прекращении реанимационных мероприятий. Если проводимые реанимационные мероприятия эффективны, то кровоток постепенно восстанавливается в обратном порядке — сначала появляется диастолическая его часть, а затем систолическая.
При ПВК IV степени у всех детей в первые часы жизни отмечается выраженная гиперперфузия мозга, ИР низкий (0,53 ± 0,01), и на протяжении последующих 2-4 дней может продолжать снижаться (0,48 ± 0,03).
Наряду с перивентрикулярными кровоизлияниями, нередко отмечаются выраженные ишемические нарушения, частота и локализация которых зависит от гестационного возраста. Так, для недоношенных детей наиболее характерно развитие перивентрикулярной лейкомаляции (ПВЛ). ПВЛ — ишемический инфаркт белого вещества головного мозга вокруг наружных углов боковых желудочков. В. Banker и J. Larroshe впервые предположили, что ПВА развивается в зонах пограничного кровоснабжения (рис. 36). Анастомозы между вентрикулопетальными и вентрикулофугальными артериями перивентрикулярной области недостаточно развиты у недоношенных детей, чем и объясняется их предрасположенность к ПВЛ. Количество анастомозов зависит от степени зрелости недоношенного ребенка. Гипоперфузия и явления обкрадывания в зонах коллатерального кровоснабжения являются основными патофизиологическими механизмами нарушения мозгового кровообращения при ПВЛ. Хроническая гипоксия и асфиксия в сочетании с артериальной гипотензией в наибольшей степени повреждают зоны с менее интенсивным кровоснабжением, что ведет к гибели нервных клеток. В области некротизированной ткани нередко происходят вторичные кровоизлияния с образованием геморрагических инфарктов (геморрагическая ПВЛ), а иногда и массивных кровоизлияний.
Рис. 36. Схемы пограничных зон кровоснабжения в перивентрикулярных областях. а — вентрикулопетальные артерии, б — вентрикулофугальные артерии, в — зона пограничного кровоснабжения, г — частота встречаемости ПВЛ.
Обширный некроз перивентрикулярного белого вещества представляет собой венозный геморрагический инфаркт и не является результатом прорыва крови из бокового желудочка в прилежащую паренхиму, как считалось ранее. Поэтому классифицировать перивентрикулярный геморрагический инфаркт как кровоизлияние IV степени неправильно. Нередко геморрагический инфаркт сочетается с перивентрикулярной лейкомаляцией.
Острая фаза ПВЛ характеризуется зоной отчетливой повышенной эхогенности, окружающей оба желудочка, преимущественно вокруг тел и затылочных рогов (рис. 37). Сложность ультразвуковой диагностики острой фазы ПВЛ в том, что у недоношенных детей до 34-й недели гестации обычно определяется ореол повышенной эхогенности вокруг боковых желудочков. Стойко сохраняющийся перивентрикулярный ореол, не уменьшающийся при динамическом ультразвуковом исследовании в течение двух-трех недель жизни, является достоверным эхографическим признаком ПВЛ.
Рис. 37. ПВЛ. Острая фаза. Эхограммы в коронарной и сагиттальной плоскостях.
Анализ результатов исследования показателей гемоликвородинамики на первой неделе жизни у детей с ПВЛ позволяет выявить достоверное снижение, по сравнению с детьми контрольной группы, артериального давления, более высокий ИР мозговых сосудов и низкий кровоток в системе глубоких вен мозга (ИР 0,8 ± 0,1). Падение диастолической скорости кровотока свидетельствует о резком снижении мозгового кровотока и развитии ишемии мозга. При этом на эхограммах на второй-третьей неделе жизни отмечают появление неоднородного перивентрикулярного отека и развитие мелких псевдокист (рис. 38). При этом у новорожденных с нормальным внутричерепным давлением происходит снижение тонуса мозговых сосудов и нормализация кровотока в вене Галена. При повышенном внутричерепном давлении сохраняется высокий ИР (0,8 ± 0,87), что свидетельствует о стойкой ишемии мозга и является неблагоприятным прогностическим признаком, отражающим тяжесть и необратимость поражений мозга.
Рис. 38. ПВЛ. Кистозная стадия. Эхограммы (а-в), высокий ИР.
Таким образом, при выявлении у недоношенного ребенка признаков ПВЛ для определения тяжести повреждения мозга и прогноза ближайших последствий следует динамически определять артериальное и внутричерепное давление, а также ИР в передней мозговой артерии. Высокий, длительно сохраняющийся вне зависимости от проводимого лечения ИР, выраженная внутричерепная гипертензия являются крайне неблагоприятными прогностическими признаками. При этом повторные эхограммы в возрасте 1-3 мес выявляют умеренную вентрикуломегалию, расширение межполушарной щели (более 4 мм), высокий ИР (0,8 ± 0,01), что может трактоваться как признак атрофии мозга (рис. 39). Клинически у таких детей отмечают формирование ДЦП в форме спастической диплегии.
Рис. 39. Расширение межжелудочковой щели, симметричная начальная вентрикуломегалия (а) у ребенка с кистозной ПВЛ (б).
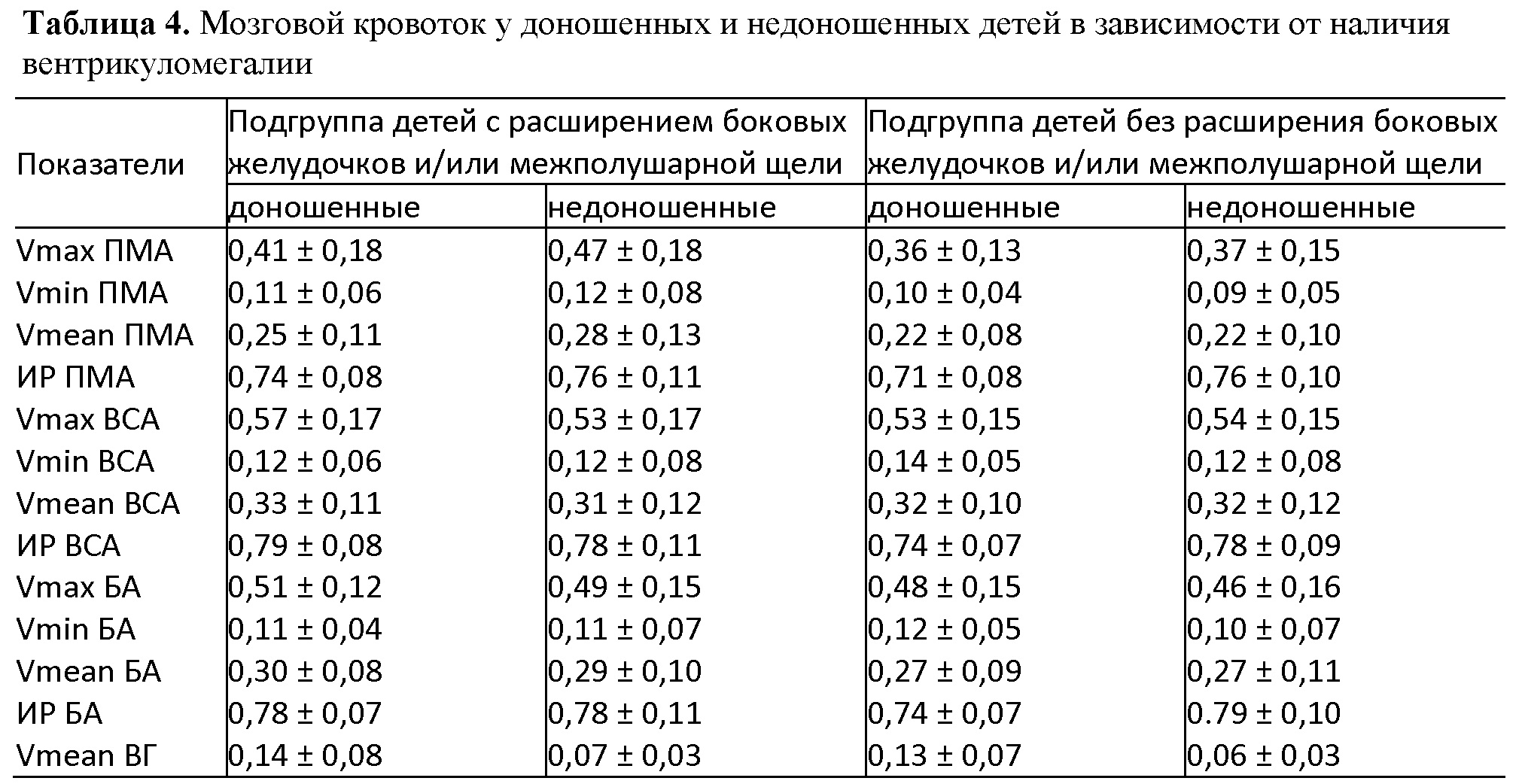
У детей с вентрикуломегалией, как постгеморрагической, так и без указаний на предшествующее кровоизлияние, при незначительном расширении боковых желудочков без прогрессирования отклонений в профиле мозгового кровотока не выявляется (табл. 4). Нет и достоверной зависимости между скоростями мозгового кровотока, ИР и внутричерепным давлением. Если же вентрикуломегалия прогрессирует, то отмечается снижение скоростей кровотока, больше диастолической, и увеличение ИР. У недоношенных с расширением желудочковой системы отмечалось достоверное увеличение всех трех скоростей в передней мозговой артерии и увеличение скорости кровотока в вене Галена по сравнению с остальными пациентами. Индексы резистентности и пульсации обследованных артерий между указанными группами детей достоверно не различались. При пункции желудочков или при наложении шунта скорости мозгового кровотока быстро восстанавливаются. Таким образом, допплерографическое динамическое наблюдение за показателями мозгового кровотока может на ранних этапах выявить несостоятельность шунта при гидроцефалии.
Таблица 4. Мозговой кровоток у доношенных и недоношенных детей в зависимости от наличия вентрикуломегалии
3.2 Изменения мозгового кровотока в раннем восстановительном периоде перинатальной энцефалопатии
Для выявления особенностей мозговой гемодинамики у новорожденных детей при перинатальном поражении головного мозга был проведен анализ средних показателей допплерограммы в группах доношенных и недоношенных детей (табл. 5). Скорости мозгового кровотока (максимальная, минимальная и средняя) во всех трех обследованных артериях и вене Галена были достоверно выше в раннем восстановительном периоде перинатальной энцефалопатии по сравнению с острым в обеих группах детей, т.е. увеличивались с возрастом.
В остром периоде (первые 28 дней жизни) были выявлены изменения скоростей кровотока по различным мозговым сосудам между группами детей, родившихся доношенными и недоношенными. У доношенных детей скорости в базилярной артерии были выше, во внутренней сонной артерии были выше минимальная и средняя скорости. Максимальная скорость также повышена недостоверно. В передней мозговой артерии достоверно выше была лишь минимальная скорость, различия максимальной и средней скоростей были недостоверными. Скорость кровотока в вене Галена была больше, чем у недоношенных новорожденных с высокой степенью достоверности.
В раннем восстановительном периоде у детей с клиникой гипертензионно-гидроцефального синдрома выявляется повышение скоростей кровотока в передней мозговой артерии и средней скорости в вене Галена (табл. 6). Вероятно, такое усиление кровоснабжения в «зоне интереса», в бассейне передней мозговой артерии, является компенсаторным после перенесенной гипоксии и объясняется большей потребностью пораженной области в кислороде и питательных веществах для восстановительных процессов.
В восстановительном периоде у доношенных детей с синдромом общего угнетения ЦНС (который часто является клиническим проявлением травмы шейного отдела спинного мозга) отмечается повышение максимальной и средней скорости в базилярной артерии и скорости в вене Галена. По аналогии с изменениями кровотока при гипертензионно-гидроцефальном синдроме усиление кровотока в бассейне базилярной артерии в данной группе пациентов можно трактовать как компенсаторное. Хотя видимых структурных изменений при эхографии не отмечается, можно предположить, что имели место микроповреждения в отделах мозга, питаемых базилярной артерией.
В восстановительном периоде у обследованных недоношенных детей с синдромом угнетения были достоверно ниже все три скорости кровотока в передней мозговой артерии, выше индексы резистентности и пульсации в передней мозговой и базилярной артериях. Показатели кровотока во внутренней сонной артерии не различались в подгруппах детей, имевших и не имевших указанный синдром.
Синдром возбуждения отмечается у более зрелых детей с более легким поражением нервной системы. В отношении показателей мозгового кровотока в этой подгруппе имелись отличия от значений ИР и пульсации передней мозговой артерии, они были достоверно ниже.
У детей с судорожным синдромом во время приступов отмечается снижение ИР мозговых артерий за счет повышения диастолической скорости, что может быть связано с высокой метаболической активностью мозга в этот период. В межприступном периоде, напротив, у таких детей выявляется снижение скоростей артериального кровотока и повышение ИР по сравнению со здоровыми детьми.
У недоношенных детей синдром мышечной дистонии свидетельствует о более серьезном поражении мозга, при этом отмечается патологическое повышение резистентности в бассейне внутренней сонной артерии (табл. 7). У большинства недоношенных детей с гипертензионно-гидроцефальным синдромом при эхографии выявляются последствия кровоизлияний и признаки вентрикуломегалии, а также усиление кровоснабжения в «зоне интереса», в бассейне передней мозговой артерии. При задержке психомоторного развития, которая диагностировалась у недоношенных детей при катамнестическом обследовании в более старшем возрасте, изменения в мозговом кровотоке не регистрировались, поскольку он уже был скомпенсированным. Клинические синдромы у недоношенных детей, характеризующие легкую степень перинатального поражения ЦНС (синдром общего угнетения и повышенной нервно-рефлекторной возбудимости), как правило, не сопровождались отклонениями в показателях мозгового кровотока. Синдром вегето-висцеральных дисфункций встречался нечасто и также не сопровождался явными изменениями кровоснабжения мозга.
Обобщая анализ полученных результатов исследований у новорожденных, перенесших асфиксию в перинатальном периоде, можно сделать следующие выводы:
— наиболее глубокие нарушения мозгового кровообращения наблюдаются у новорожденных детей, перенесших острую асфиксию интранатально, и у недоношенных новорожденных с внутриутробной гипоксией;
— характерным является обнаружение низкой резистентности в бассейне внутренней сонной артерии, сменяющейся ко второму часу жизни существенным ее возрастанием;
— относительная нормализация кровоснабжения мозга достигается лишь у доношенных новорожденных с хронической внутриуробной гипоксией. У новорожденных, перенесших острую асфиксию и, особенно, у недоношенных детей на фоне гипоперфузии мозга наблюдается относительное преобладание кровоснабжения в бассейне передней и средней мозговых артерий и снижение его в регионах, перфузируемых базилярной артерией;
— для большинства обследованных новорожденных детей характерным является ишемический характер нарушений мозгового кровообращения. Противоположный тип изменений наблюдается в случаях развития перивентрикулярных кровоизлияний, когда регистрируется резкое снижение резистентности всех сосудистых систем, проявляющееся гиперперфузией головного мозга. Сохранение и усиление такого типа нарушений мозгового кровообращения, а также наличие флюктуирующего характера мозгового кровотока закономерно приводит к возникновению пери-интравентрикулярных кровоизлияний, нередко в сочетании с перивентрикулярной лейкомаляцией;
— основными факторами, влияющими на допплеровские показатели мозгового кровотока у детей с перинатальной энцефалопатией после выхода из критического состояния, являются масса тела, гестационный возраст и постнатальный возраст. Так, сравнение динамики индексов резистентности и пульсации мозговых артерий у недоношенных и доношенных детей показало, что у первых имелась четкая обратная зависимость индексов от массы тела и возраста. С ростом ребенка они достоверно снижались, приближаясь к значениям доношенных детей. У детей, родившихся доношенными, зависимости индексов от массы тела и возраста выявлено не было, т.е. резистентность сосудов в этой группе более стабильна относительно антропометрических факторов, это было установлено ранее в отношении здоровых детей;
— интенсивность кровоснабжения различных отделов мозга у доношенных и недоношенных детей с перинатальной энцефалопатией имеет существенные различия, что может быть связано с морфофункциональными особенностями различных отделов;
— наблюдение за состоянием мозгового кровотока у детей с пери-натальным поражением мозга средней и тяжелой степени позволяет сделать вывод, что усиление регионарного кровотока в раннем восстановительном периоде носит компенсаторно-адаптационный характер и может служить благоприятным прогностическим признаком;
— при перинатальной энцефалопатии, характеризующейся поражением головного мозга легкой степени тяжести и проявляющейся синдромами повышенной нервно-рефлекторной возбудимости у доношенных детей, повышенной нервно-рефлекторной возбудимости и общего угнетения у недоношенных детей, отклонений в профиле мозгового кровотока не выявляется.
4. Изменения мозгового кровотока при инфекциях
Большинство инфекционных поражений головного мозга у новорожденных детей диагностируется на основании клинического и лабораторных методов обследования. Нейросонография не только имеет определенное значение в диагностике воспалительных заболеваний, но и позволяет осуществлять наблюдение за развитием патологического процесса и своевременно выявлять осложнения (гидроцефалию, вентрикулит, церебральный абсцесс, субдуральную гигрому и т.д.), Также она позволяет диагностировать специфическое поражение головного мозга при внутриутробных инфекциях: токсоплазмозе, цитомегалии, краснухе и др. (рис. 40—42).
Рис. 40-41. Микрокальцификаты у ребенка с врожденной цитомегаловирусной инфекцией. Специфический васкулит, уплотнение стенок стриарных артерий у ребенка с врожденным токсоплазмозом.
Генерализованная внутриутробная инфекция с церебральными повреждениями, в частности герпетический и цитомегаловирусный энцефалит, сопровождается снижением всех скоростей кровотока и стойким выраженным снижением ИР — вазопараличом. Это может быть обусловлено как сдавлением мелких сосудов отечной мозговой тканью, так и специфическим вирусным поражением нервных окончаний и эндотелия мозговых сосудов. Такие изменения сохраняются у выживших детей на протяжении 3-5 мес жизни, хотя и в менее выраженной форме.
Рис. 42. Декомпенсированная внутренняя гидроцефалия у ребенка после грибкового менингита. Кровоток в передней мозговой артерии (а) с высоким ИР (б), в стриарных артериях (в) и в вене Галена (г, д).
При пневмониях легкой и средней степени тяжести изменений мозгового кровотока не обнаруживается. При тяжелой пневмонии с нейротоксикозом, выраженным инфекционным токсикозом и особенно при высоком уровне мочевины в крови мозговой кровоток увеличивается, причем диастолическая скорость возрастает больше систолической. Снижение мозгового кровотока при пневмонии более свойственно детям с внутриутробной гипотрофией, морфофункциональной незрелостью и, как правило, при надпочечниковой недостаточности и низком системном артериальном давлении, что еще раз подчеркивает автономность мозгового кровообращения; для срыва его регуляции требуются значительные нарушения гомеостаза.
5. Состояние центральной и церебральной гемодинамики у новорожденных детей с перинатальной энцефалопатией
В остром и восстановительном периодах перинатального поражения ЦНС помимо допплеровской оценки мозгового кровотока нами проводилось эхокардиографическое исследование, включавшее в себя и допплерографию. Обобщенные данные этого обследования представлены в табл. 8.
Таблица 8. Показатели центральной гемодинамики у детей с ПЭП
Абсолютные показатели сердечного выброса, измеренные различными способами, — общий ударный объем, эффективный сердечный выброс и минутный объем кровообращения — были выше у доношенных детей как в остром, так и в восстановительном периодах перинатальной энцефалопатии (ПЭП). Корреляционный анализ подтвердил, что значения сердечного выброса, так же как и скорости мозгового кровотока, увеличивались с увеличением массы тела.
Относительные показатели сердечного выброса на 1 кг веса (сердечные индексы) — ударный объем (УО), эффективный ударный объем (УОэф), минутный объем (МО) — были выше у недоношенных детей по сравнению с доношенными. Высокие значения объемного кровотока на 1 кг веса объясняют более высокими темпами роста, большей потребностью тканей в кислороде и напряженностью метаболических процессов у незрелых детей.
Один из основных показателей насосной функции и сократительной способности миокарда — фракция изгнания — у доношенных и недоношенных детей независимо от возраста был одинаковым и соответствовал норме, указывая на стабильность работы сердца.
Для установления возможной связи между центральной и церебральной гемодинамикой был проведен корреляционный анализ между показателями сердечного выброса и допплерографическими показателями мозгового кровотока (рис. 43). У детей, рожденных раньше срока, была обнаружена достоверная положительная связь между скоростями кровотока в передней мозговой и базилярной артериях и абсолютной величиной сердечного выброса. В группе доношенных детей такой зависимости отмечено не было. При подробном анализе результатов было установлено, что связь между мозговым кровотоком и величиной сердечного выброса на протяжении первых месяцев жизни имелась не у всех недоношенных детей, а лишь у пациентов с гестационным возрастом менее 34 нед. У более зрелых недоношенных детей скорости мозгового кровотока не зависели от изменений сердечного выброса, так же как и у доношенных. В обеих группах обследованных детей имелась обратная связь между скоростями мозгового артериального кровотока и сердечными индексами, в большей степени выраженная у детей, родившихся недоношенными.
Рис. 43. Зависимость скоростей кровотока в передней мозговой артерии от величины сердечного выброса у детей с гестационным возрастом менее 34 нед.
Вероятно, это объясняется выраженной зависимостью обоих указанных параметров от массы тела: с увеличением массы тела происходит увеличение скоростей мозгового кровотока, но гораздо в меньшей степени, чем падение значений сердечного выброса на килограмм веса, поэтому связь имеет отрицательный знак.
В группе доношенных детей индексы резистентности и пульсации всех трех артерий оказались более стабильными показателями мозгового кровотока, чем скорости, — они не зависели ни от абсолютных показателей сердечного выброса, ни от сердечных индексов. В группе доношенных детей была обнаружена вероятная положительная связь индекса резистентности самой крупной артерии — внутренней сонной — с ударным и минутным сердечными индексами. В передней мозговой и базилярной артериях индексы резистентности не зависели от показателей сердечной гемодинамики.
Полученные данные говорят о том, что у детей с гестационным возрастом менее 34 нед способность к поддержанию постоянства мозгового кровотока независимо от изменений сердечного выброса, т.е. ауторегуляция, отсутствует на протяжении первых месяцев жизни. Дети со сроком гестации 34 нед и более уже способны с первых дней жизни осуществлять ауторегуляцию кровоснабжения мозга, так же как и доношенные дети. Корреляционный анализ не выявил связи между показателями мозгового кровотока и частотой сердечных сокращений в обеих группах обследованных детей.
Среди обследованных детей были пациенты с врожденными пороками сердца первой группы, в которую входят пороки с относительно благоприятным исходом: небольшой открытый артериальный проток, небольшие дефекты межпредсердной и межжелудочковой перегородок. Все пациенты с пороками сердца были обследованы кардиологом, клинических признаков нарушения кровообращения отмечено не было, хотя в этой подгруппе детей достоверно чаще, чем у остальных обследованных детей, встречался синдром вегетативных дисфункций.
Чтобы исключить возможное влияние изменений сердечной гемодинамики при пороках сердца на мозговой кровоток, был проведен сравнительный анализ показателей церебральной и центральной гемодинамики между подгруппами детей с наличием порока сердца и без него. В группе доношенных детей у пациентов с пороками сердца конечно-диастолический объем левого желудочка и величина ударного объема на килограмм веса были больше, чем у остальных детей, несмотря на то, что по возрасту подгруппы были однородны. Различий в показателях мозгового кровотока выявлено не было.
В группе детей, родившихся недоношенными, средний возраст в день обследования пациентов с пороками сердца был больше (84,2 дня), чем у остальных детей (44,5 дней). Возрастными различиями можно объяснить то, что у недоношенных детей с пороками сердца все три скорости в передней мозговой артерии, максимальная и минимальная скорости во внутренней сонной артерии были выше, а индексы резистентности этих артерий ниже, чем у остальных детей. В подгруппе пациентов с пороками сердца были достоверно больше диаметр и площадь поперечного сечения аорты. Фракция изгнания у обследованных детей с пороками сердца не изменялась и была в пределах нормы.
Полученные данные свидетельствовали о том, что пороки сердца у обследованных детей не были гемодинамически значимыми и не могли оказывать влияния на показатели мозгового кровотока.
6. Влияние на мозговой кровоток различных лекарственных средств
Допплеровские исследования благодаря их неинвазивности, легкой повторяемости, возможности производить их у постели больного позволяют оценить терапевтические и побочные воздействия на мозговой кровоток различных лекарственных веществ.
Индометацин, используемый для неинвазивного закрытия открытого боталлова протока, оказывает глубокое и длительное воздействие на мозговую гемодинамику новорожденного, выражающееся в снижении скоростей кровотока в основных мозговых артериях. Такой эффект, вероятно, связан с прямым воздействием препарата на синтез эндотелиальных простациклинов, которые повышают тонус мозговых сосудов, в результате чего перфузия головного мозга снижается на 40% от исходного уровня на протяжении 1-2 ч после введения.
Метилксантины (теофиллин, эуфиллин, кофеин), применяемые для лечения апноэ и дыхательных расстройств, в большинстве исследований снижают линейные скорости кровотока и повышают индексы резистентности. Возможно, это обусловлено не прямым сосудосуживающим эффектом, а снижением парциального напряжения углекислого газа вследствие улучшения легочной вентиляции.
Кавинтон, вводимый в остром периоде, в 50% случаев не оказывает положительного действия на гемодинамику, хотя более ранние исследования указывали на снижение сосудистого сопротивления при его использовании.
Пирацетам, вводимый внутривенно в остром периоде перинатального поражения ЦНС, снижает сосудистое сопротивление, улучшает мозговой кровоток при исходном повышении тонуса мозговых сосудов.
Маннитол, который у более старших детей используется для уменьшения отека мозга и снижения внутричерепной гипертензии, у новорожденных не оказывал эффекта в 50% случаев, у четверти детей повышал внутричерепное давление и только у оставшейся четверти снижал. Хотя у старших детей отмечено значительное повышение индекса резистентности после введения маннитола.
Но-шпа, трентал достоверных изменений мозгового кровотока не вызывают.
Фенобарбитал по последним данным не оказывает влияния на кровоток, хотя некоторые исследователи отмечают незначительное, недостоверное снижение скоростей кровотока на фоне его приема.
В последнее время большое внимание уделяется проблеме обезболивания новорожденных, получающих интенсивную терапию. При исследовании влияния морфина на мозговой кровоток различий в показателях до и после введения не выявлено (незначительно снижались среднее артериальное давление и частота сердечных сокращений), что говорит в пользу этого препарата.
Данные о влиянии кортикостероидов противоречивы и неоднозначны.
Использование сурфактанта (натурального, искусственного) позволяет существенно снизить смертность недоношенных детей с синдромом дыхательных расстройств. Однако имеются данные об увеличении частоты появления ПВК у новорожденных, получавших этот препарат, временном падении скорости мозгового кровотока после эндотрахеальной инстиляции сурфактанта, что, возможно, связано со снижением сопротивления легочных сосудов и лево-правым шунтом через боталлов проток. Авторы подчеркивают необходимость мониторирования мозгового кровотока при лечении сурфактантом.


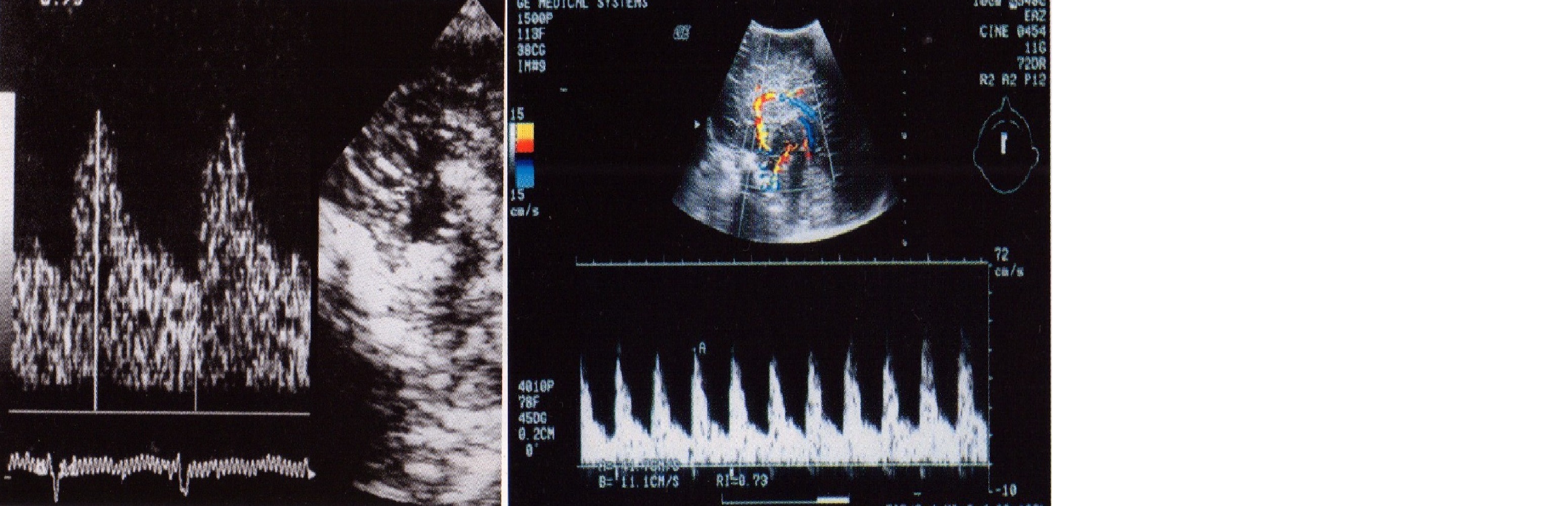

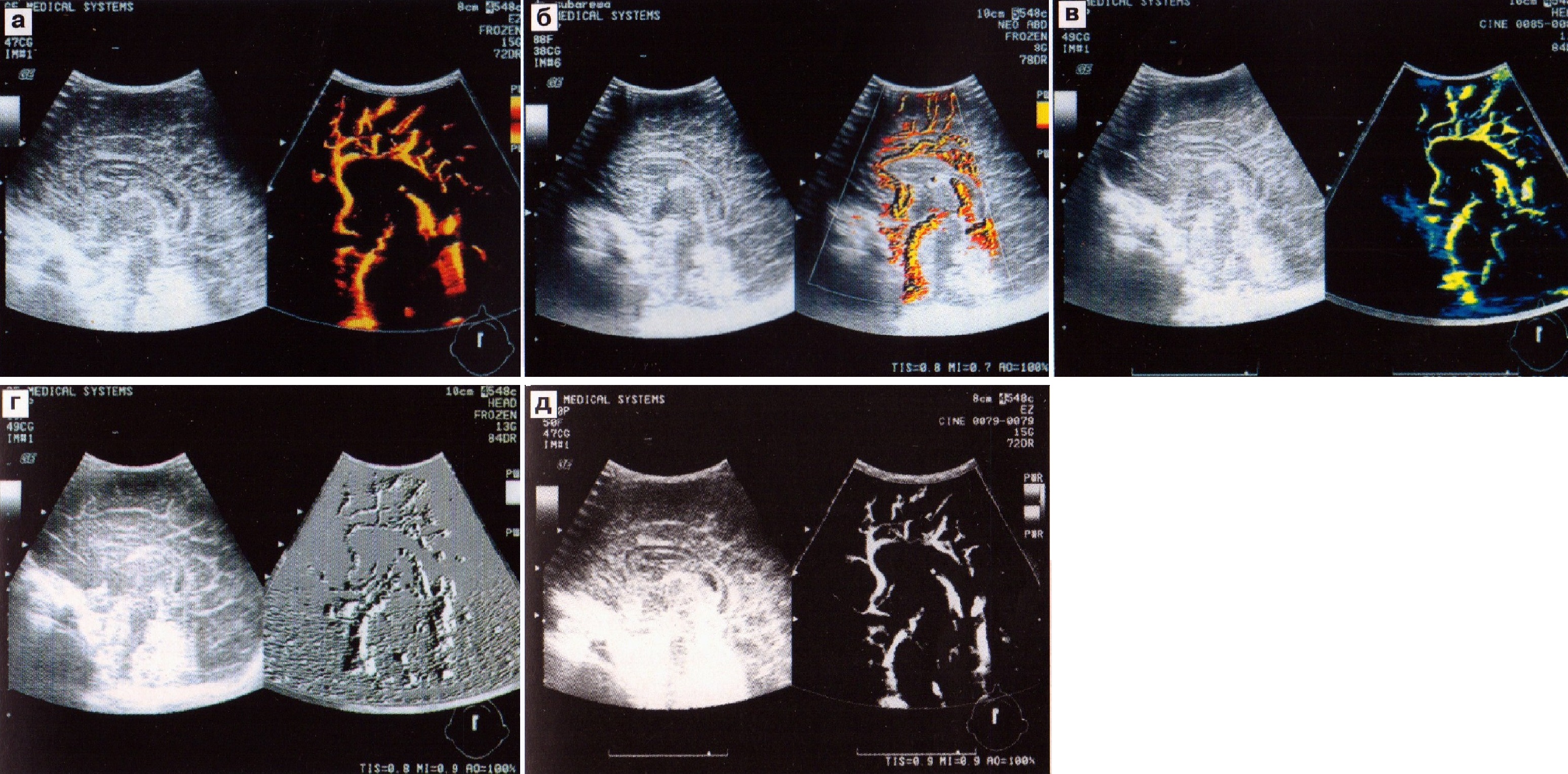
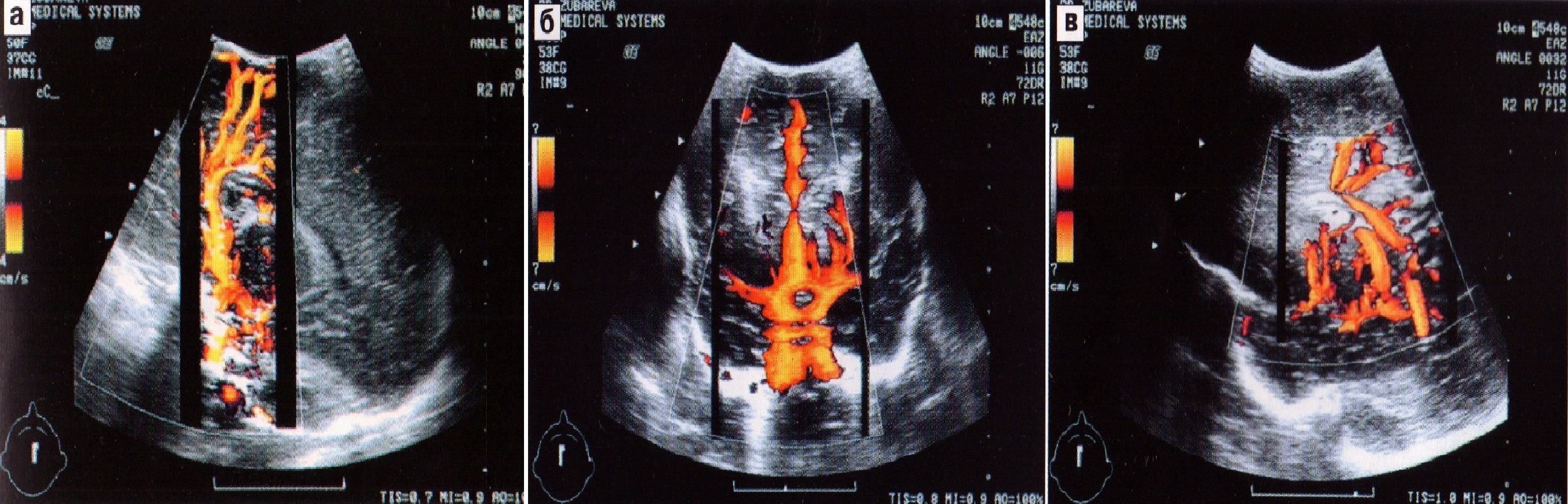

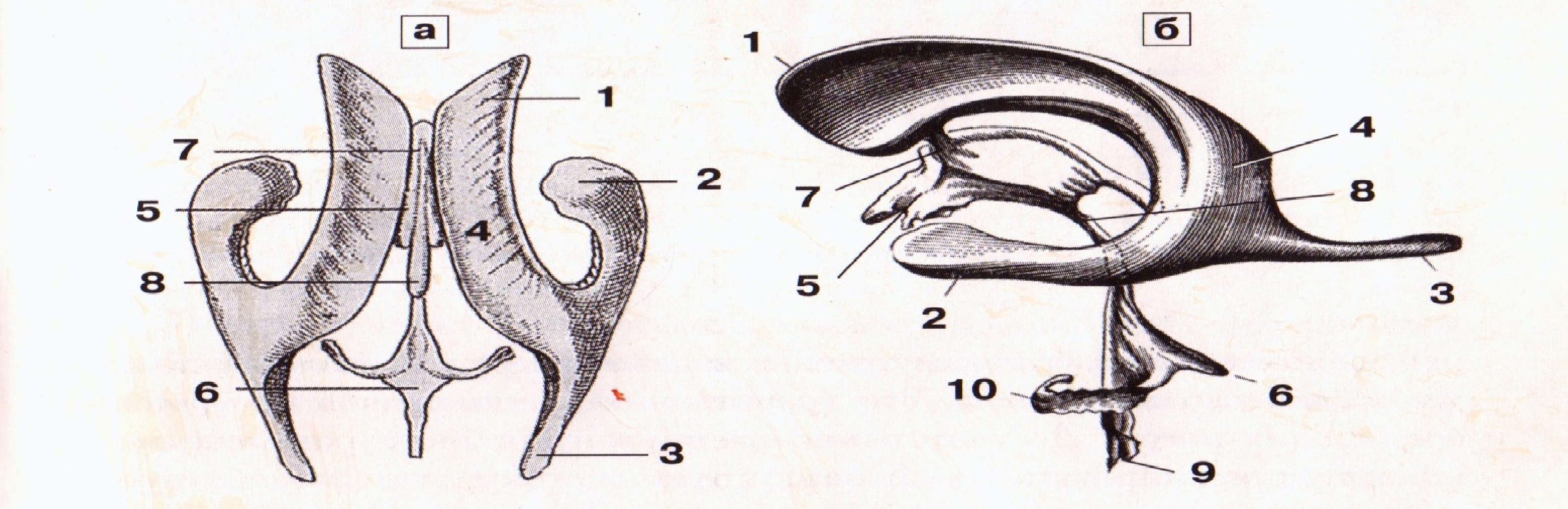
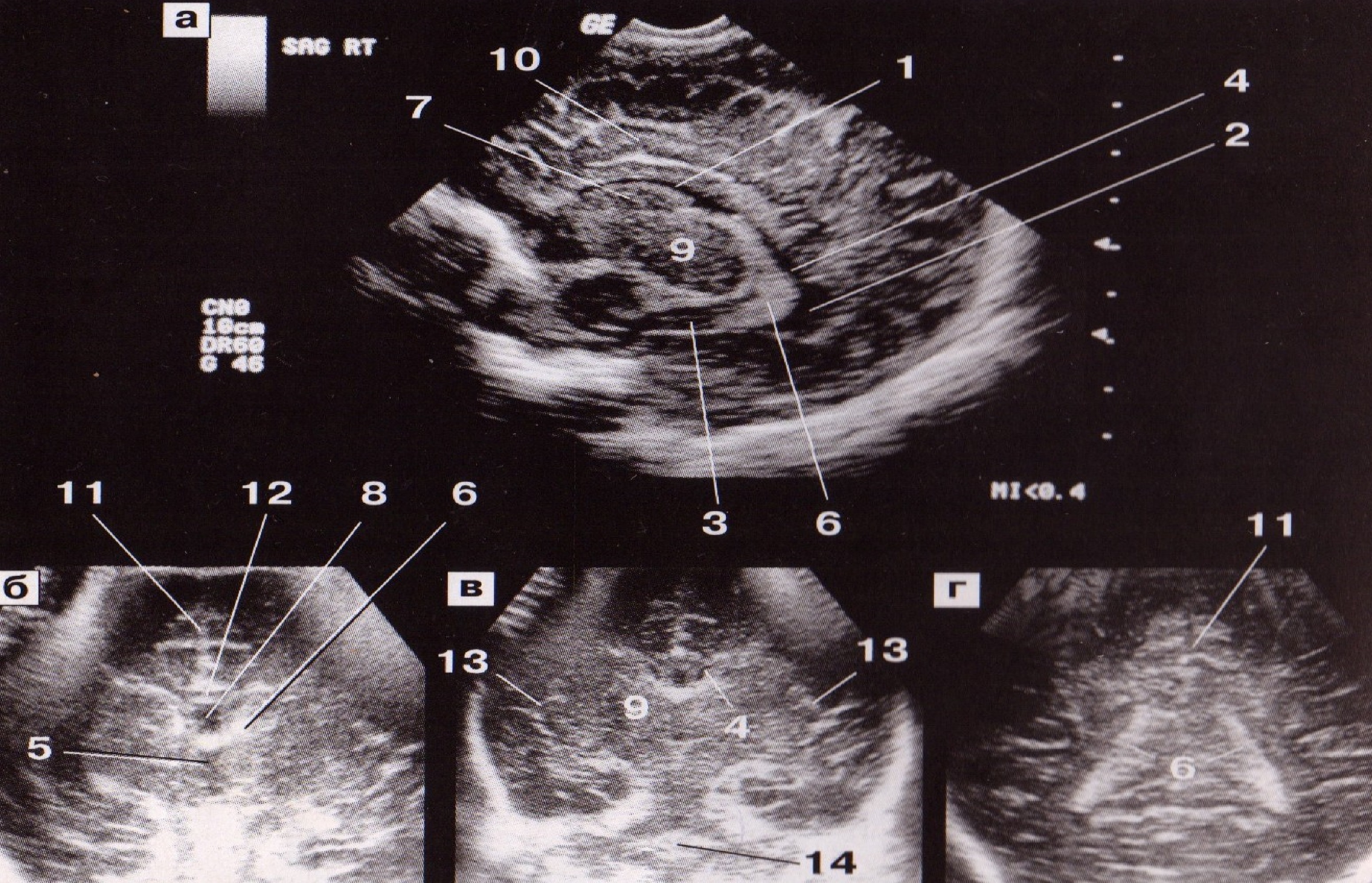
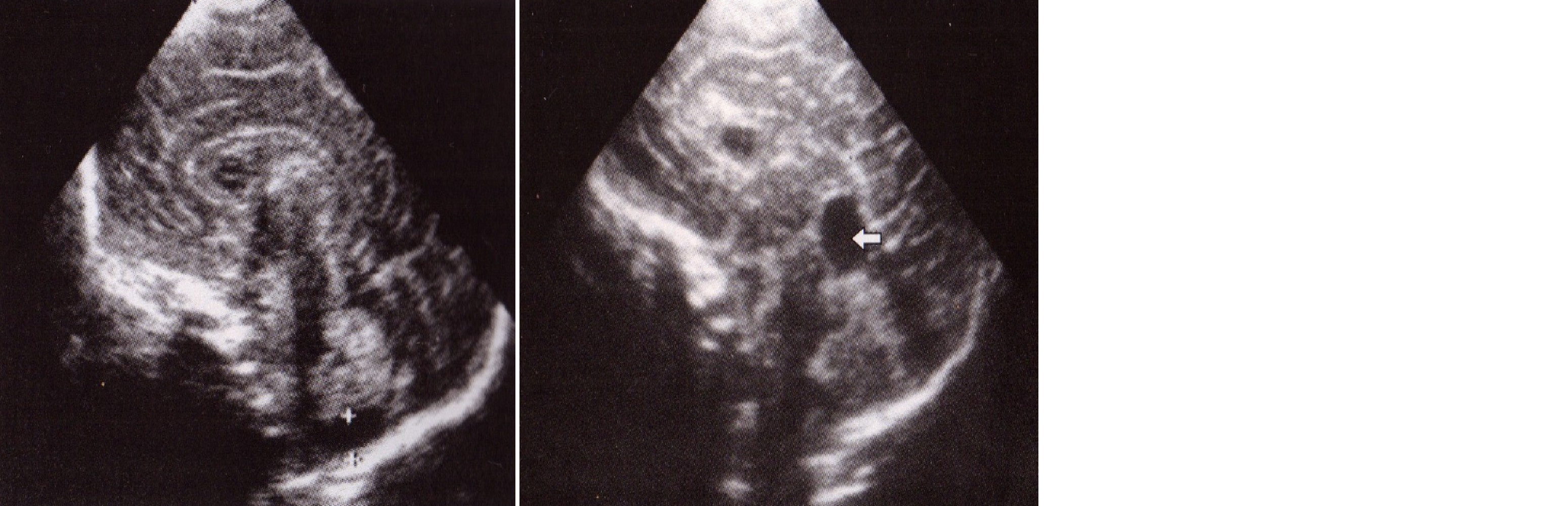
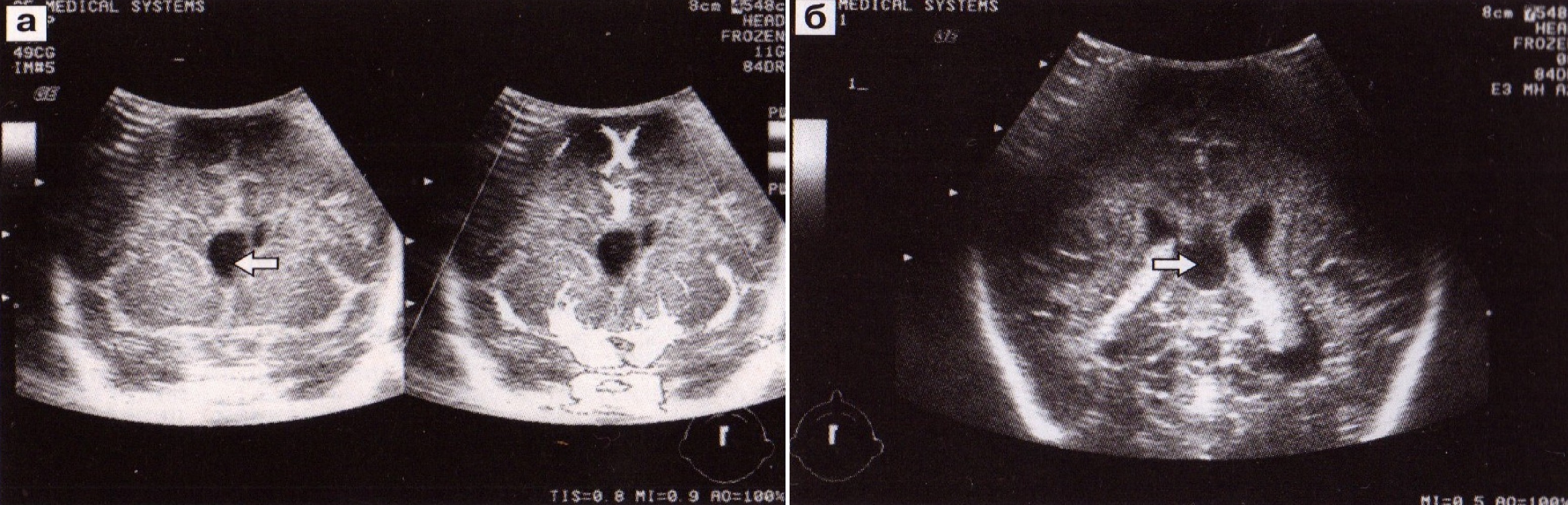

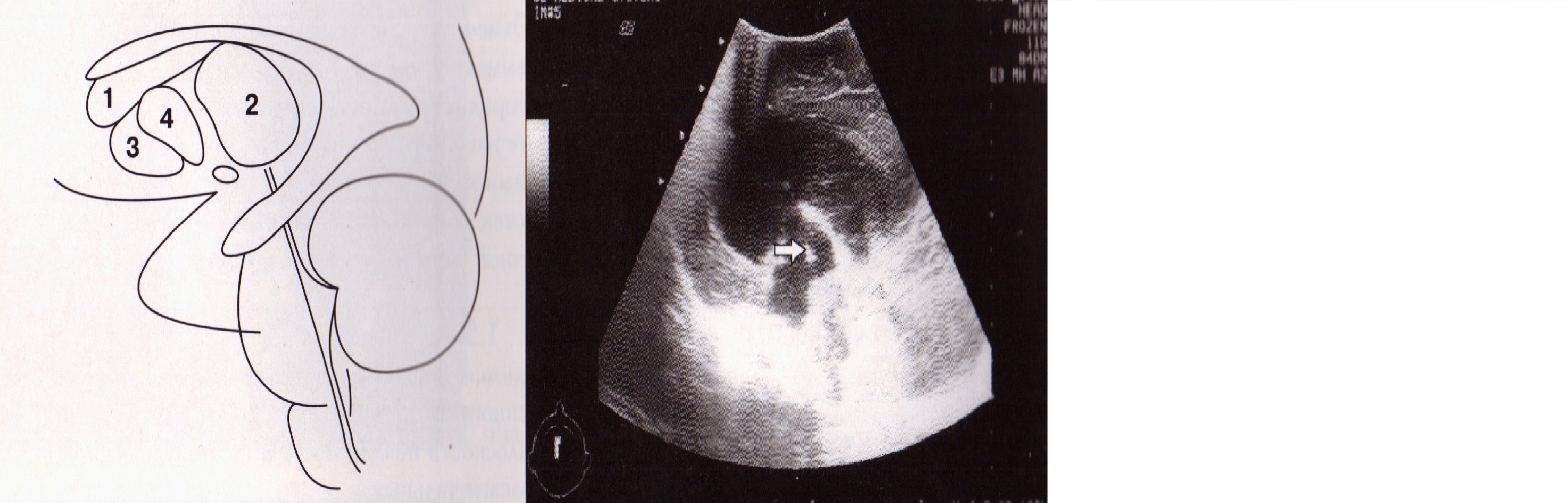
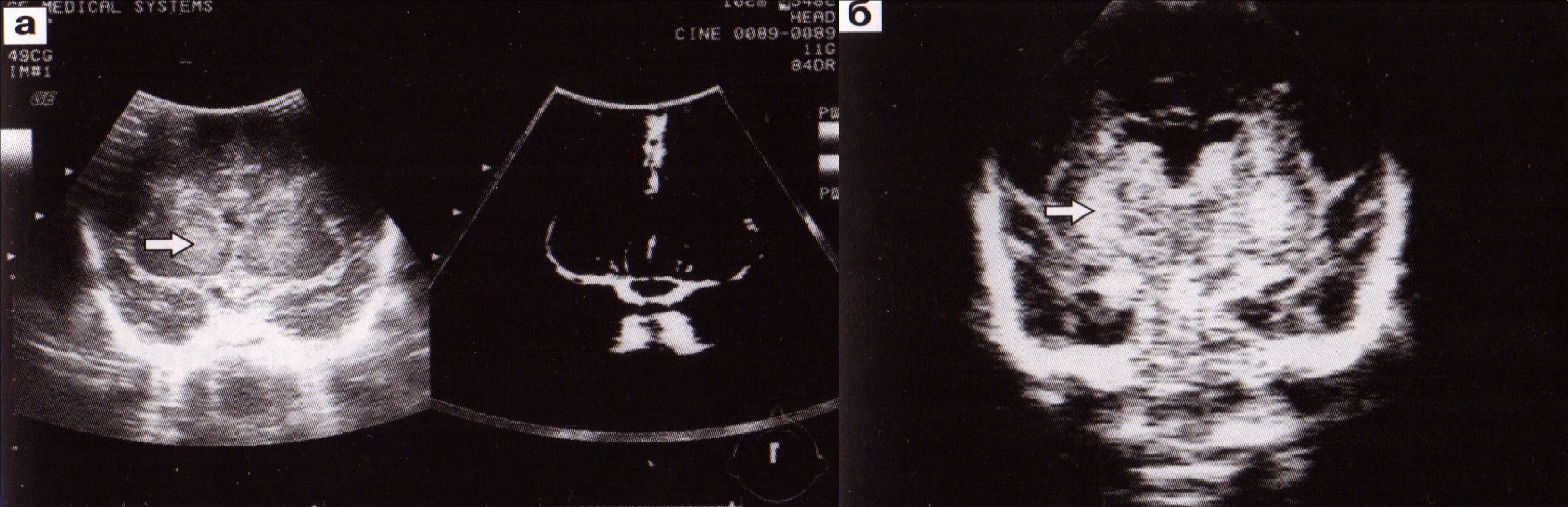
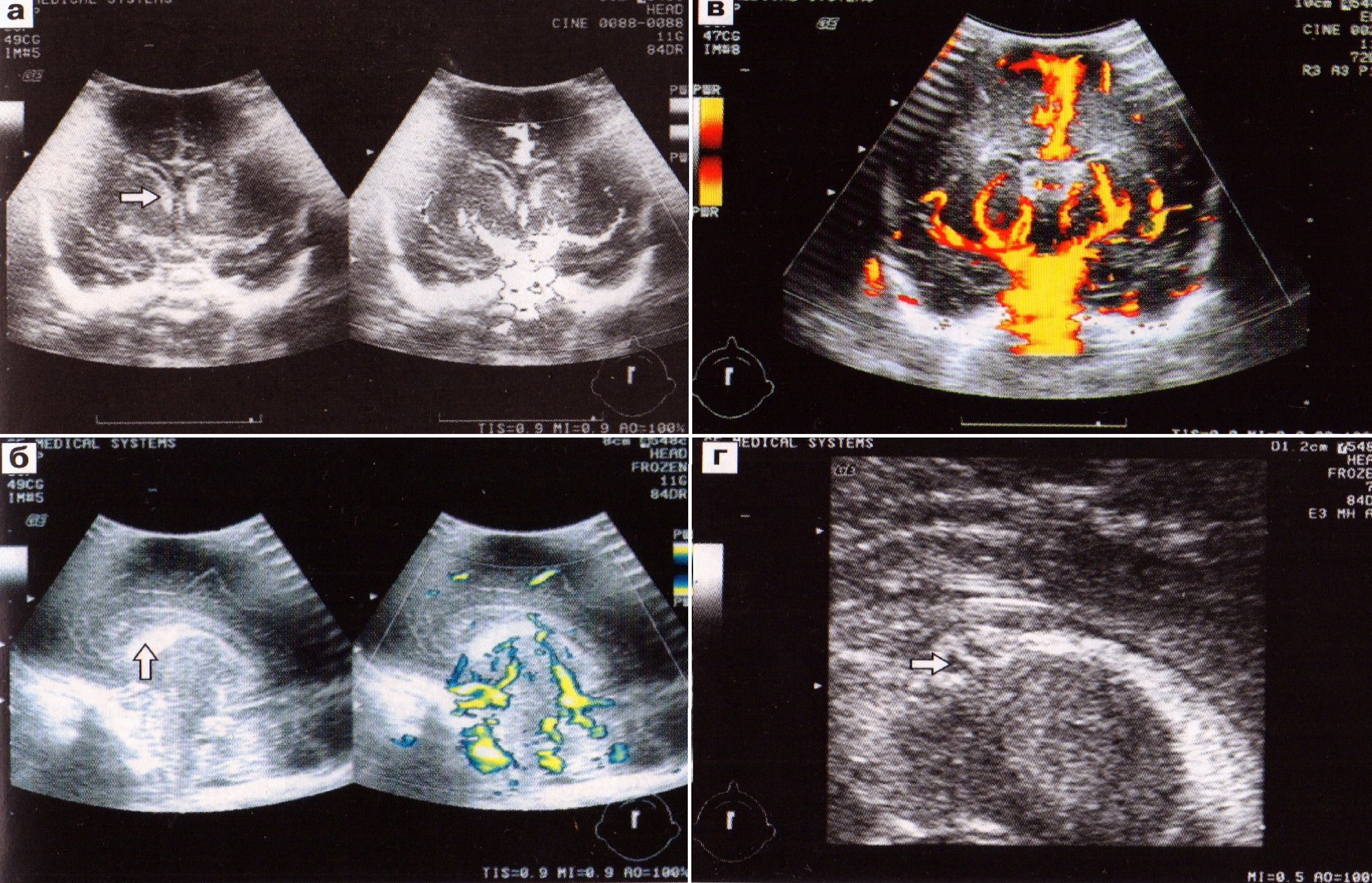
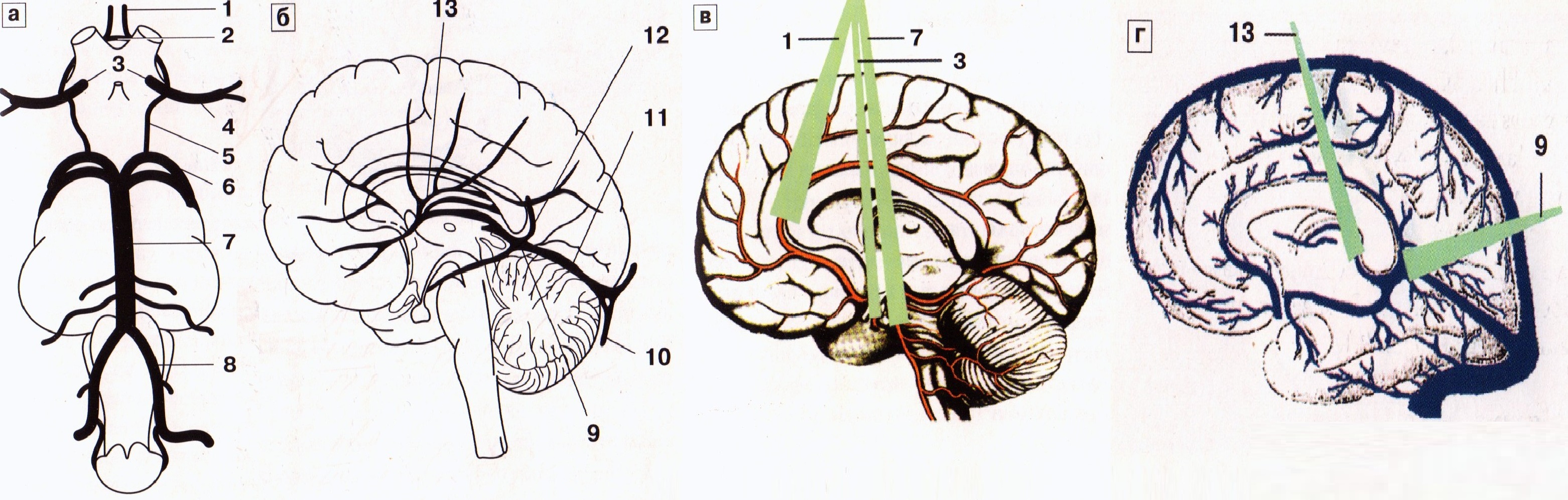
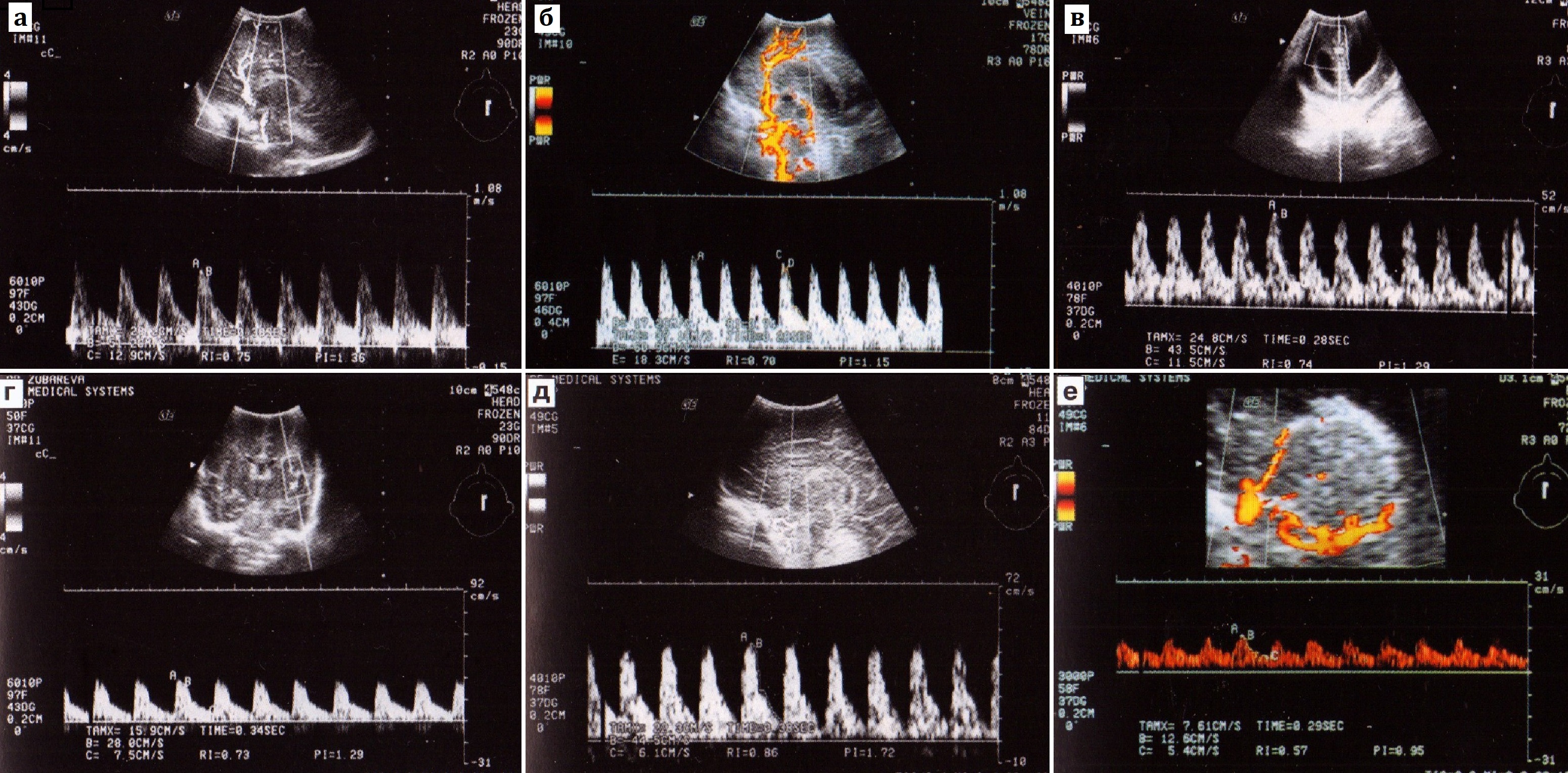
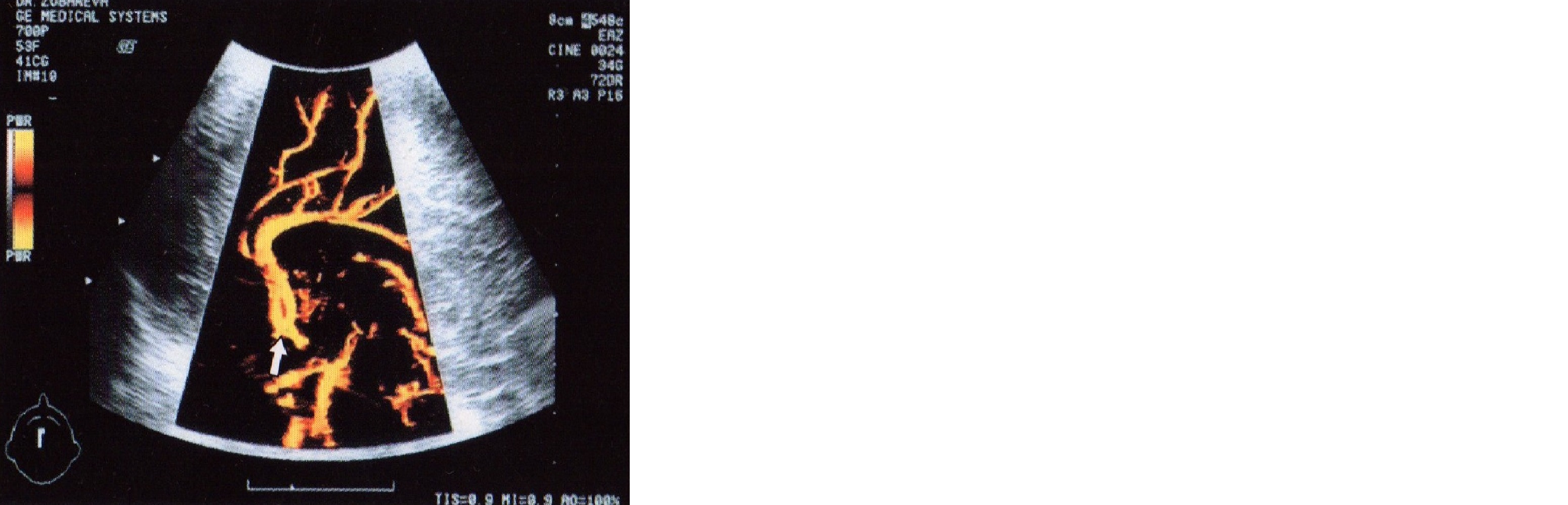

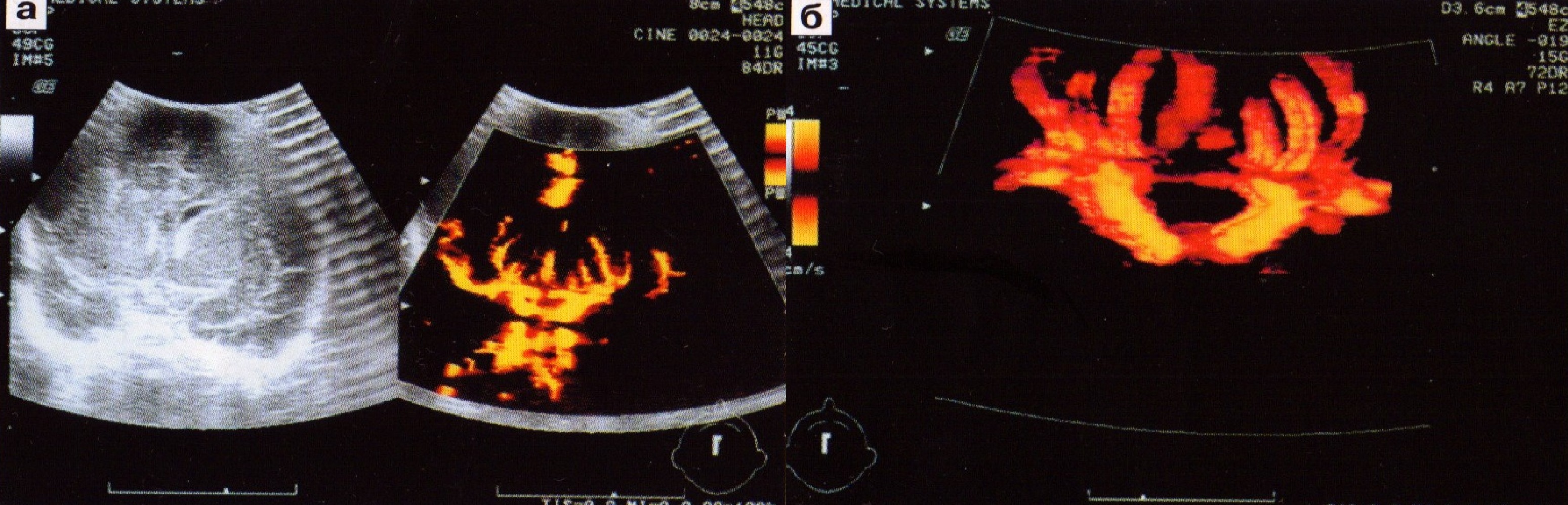
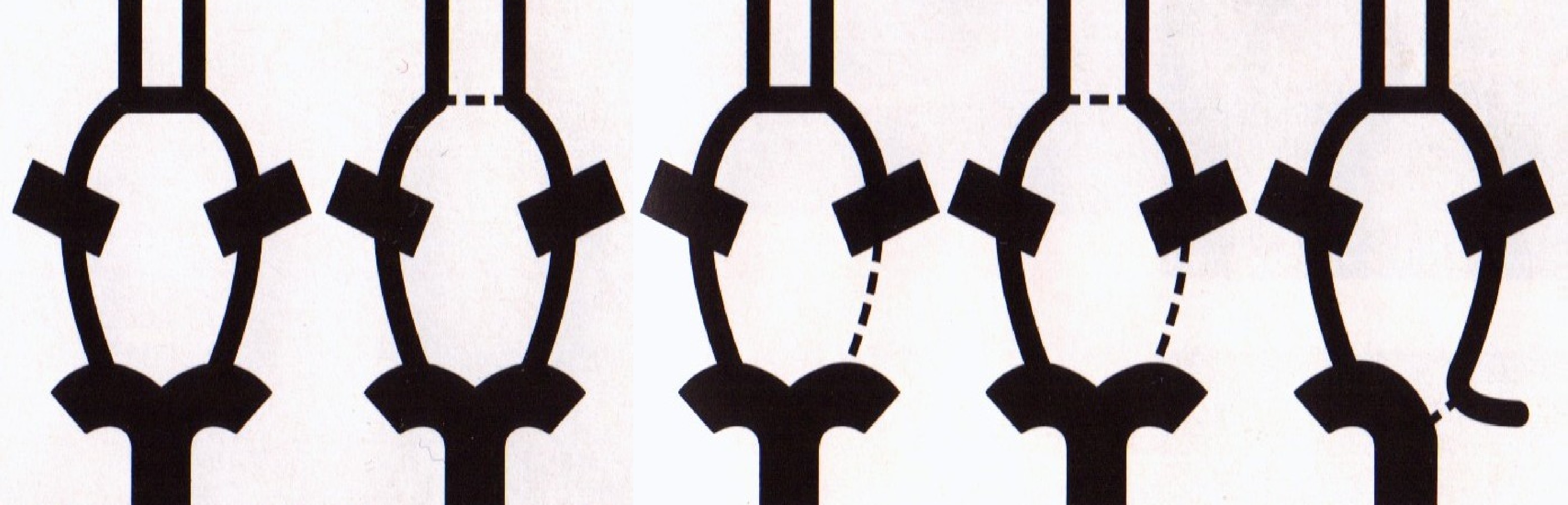
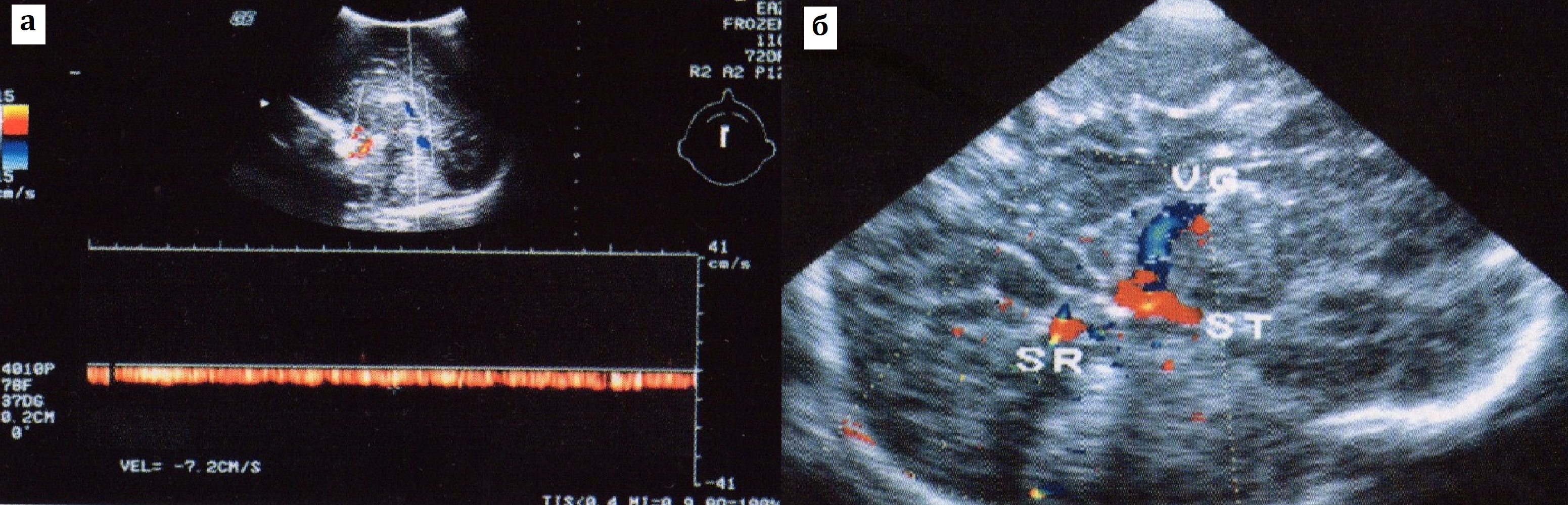
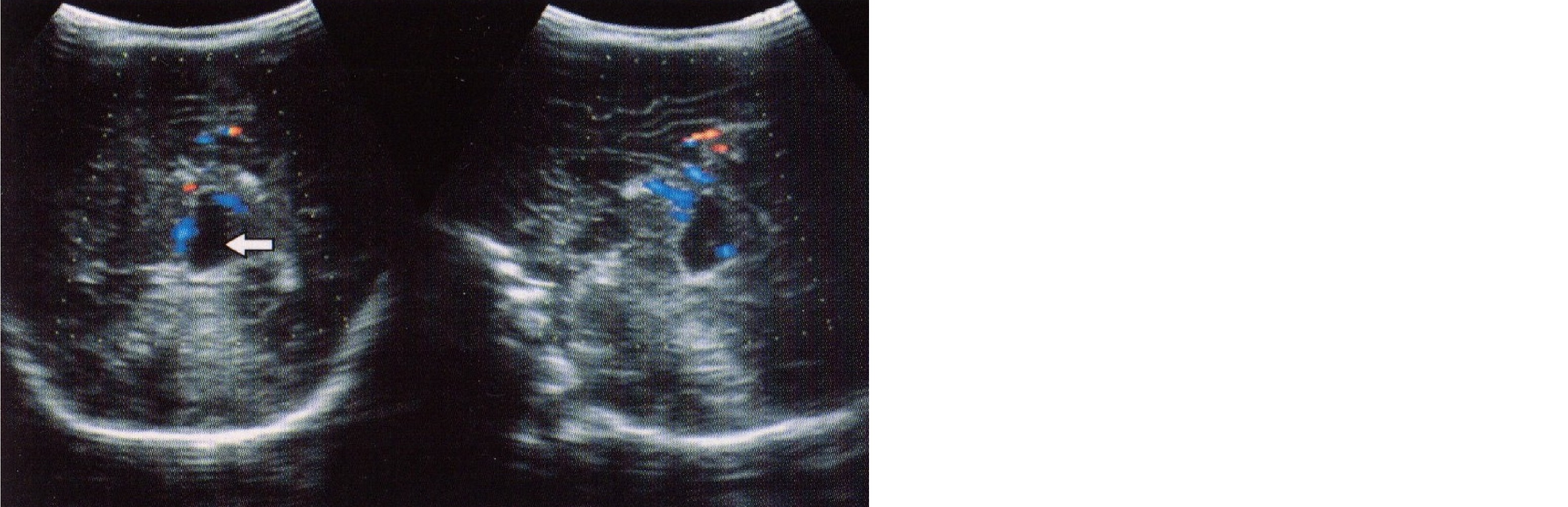
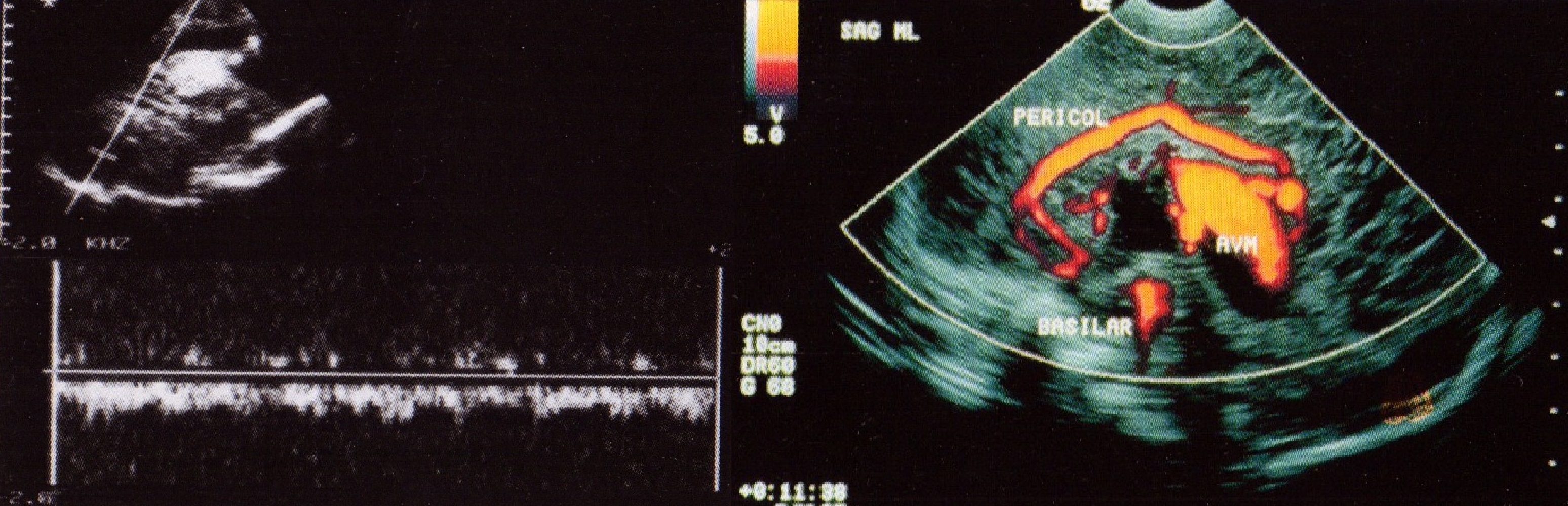
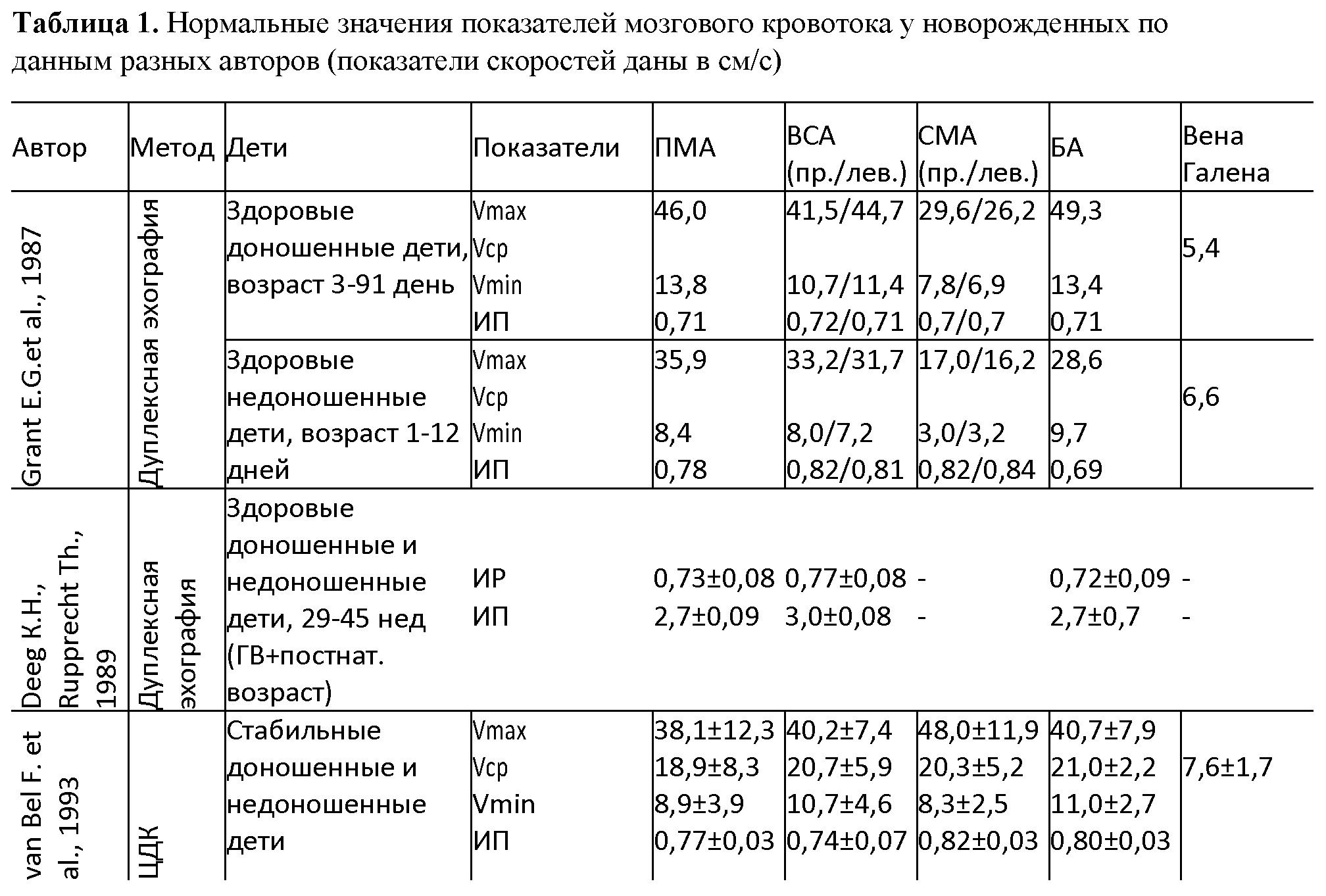
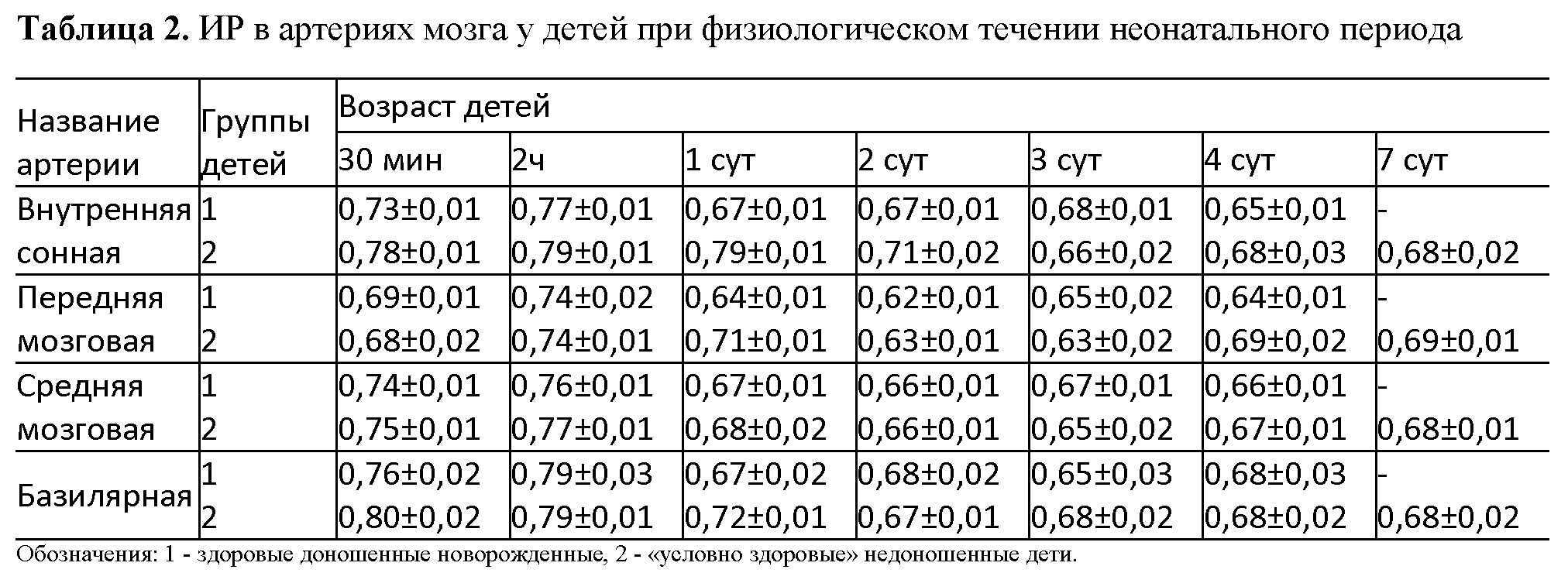

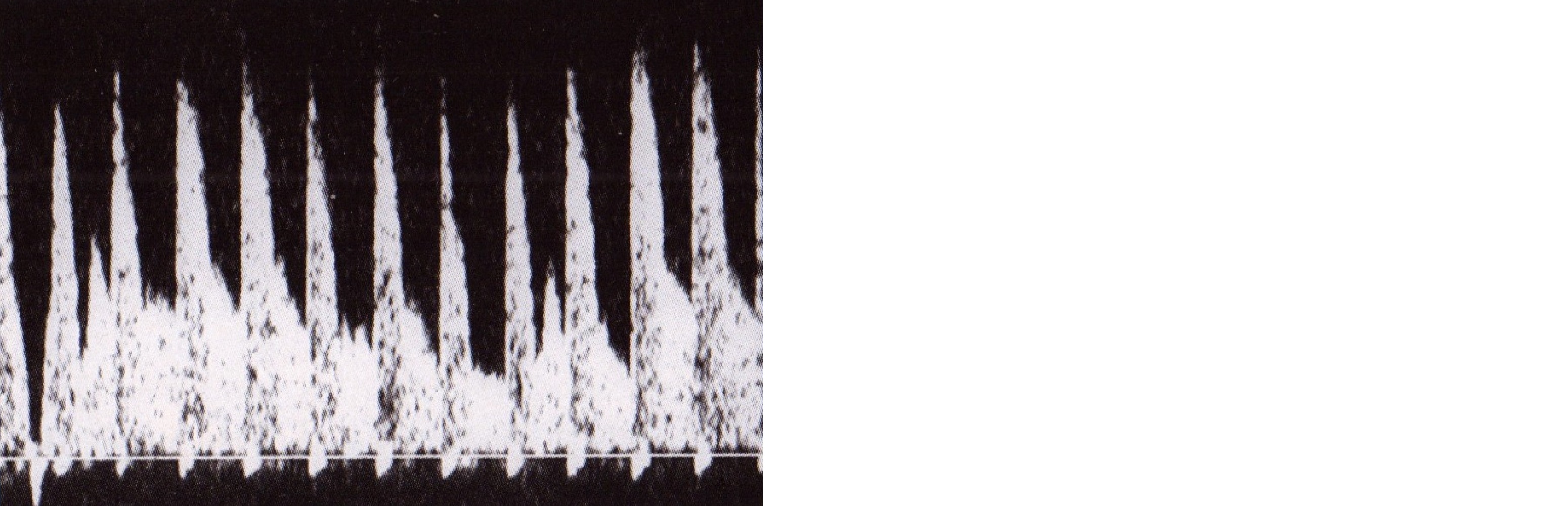
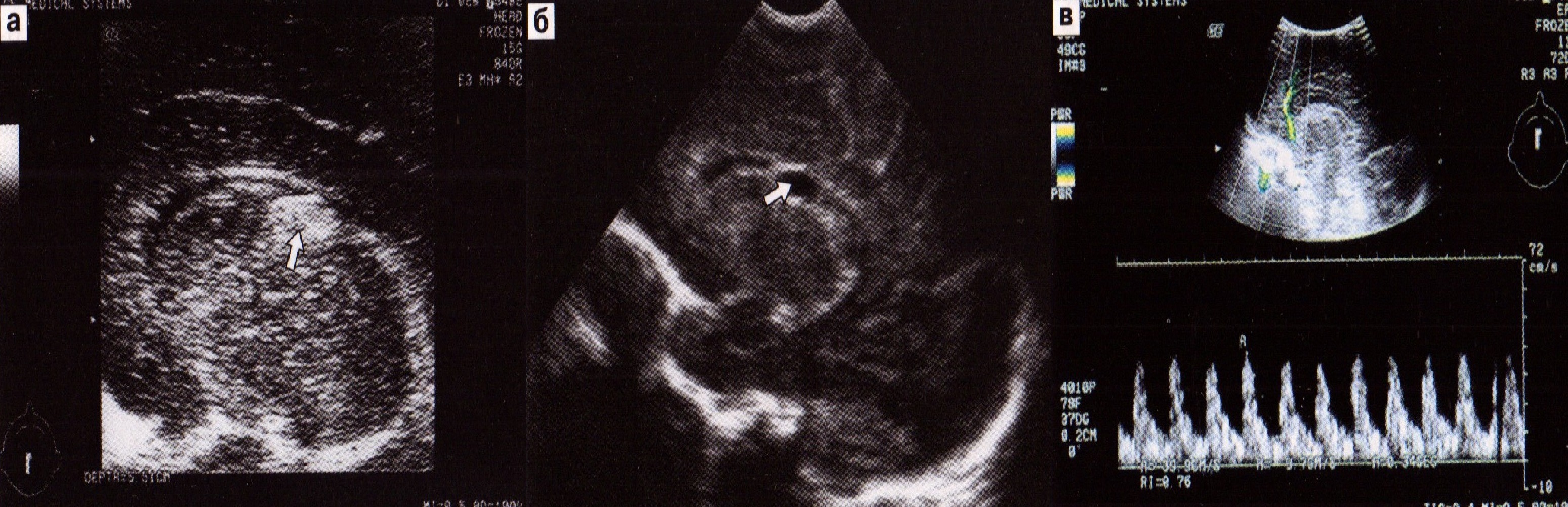
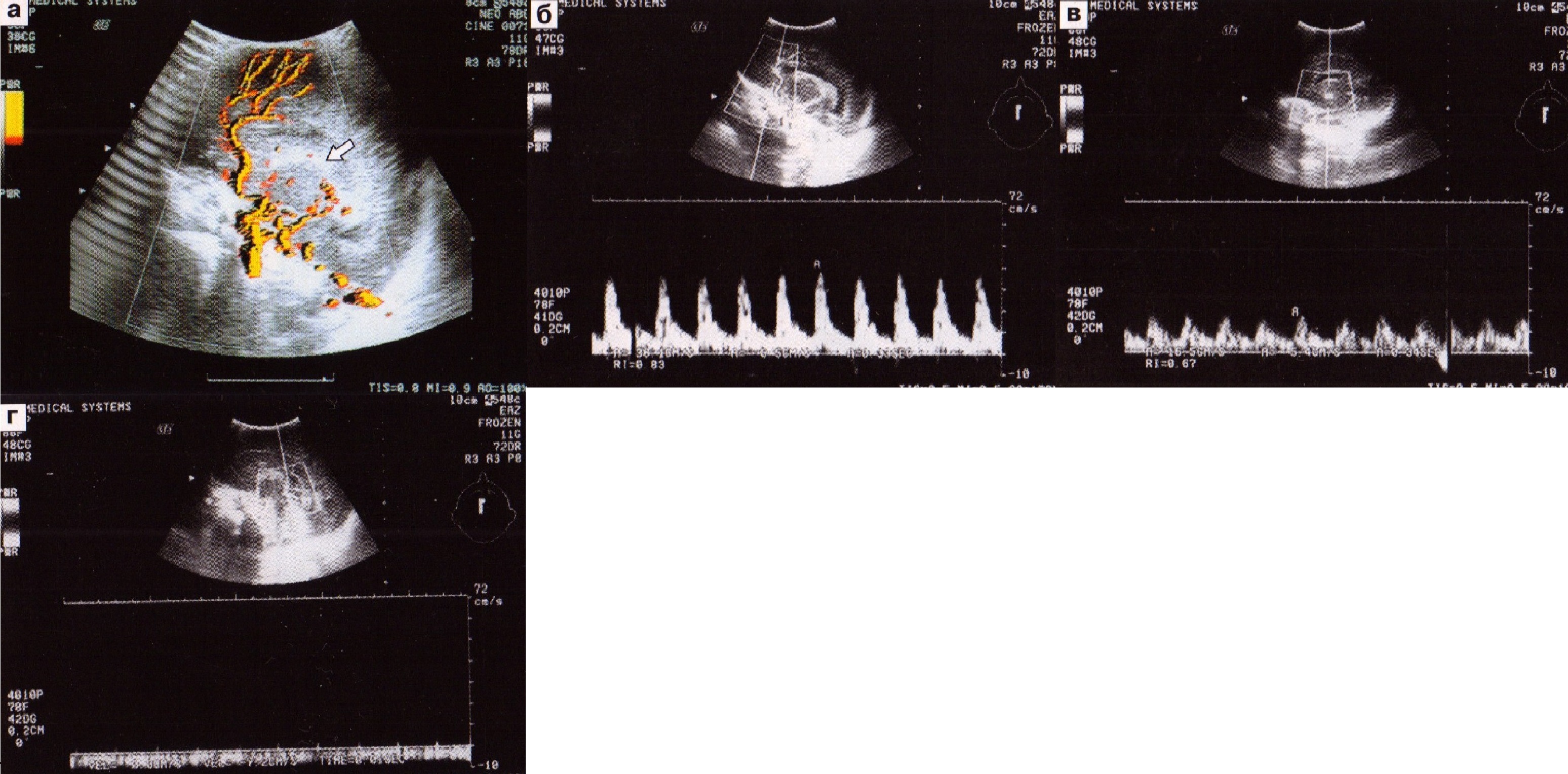
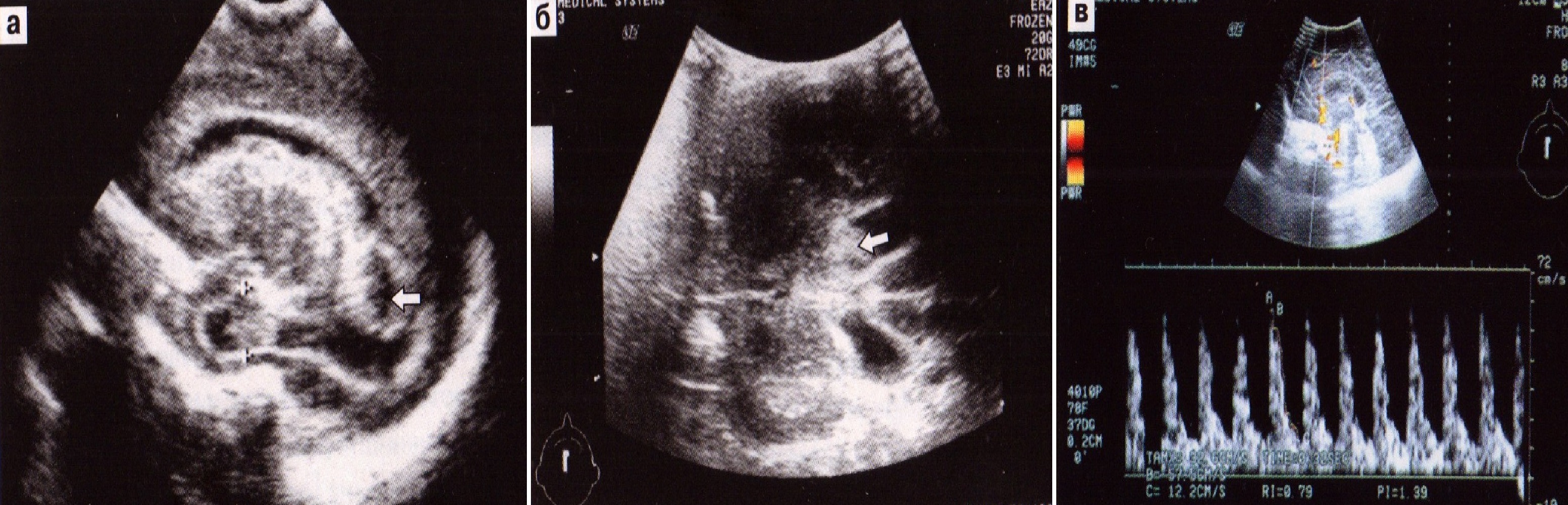
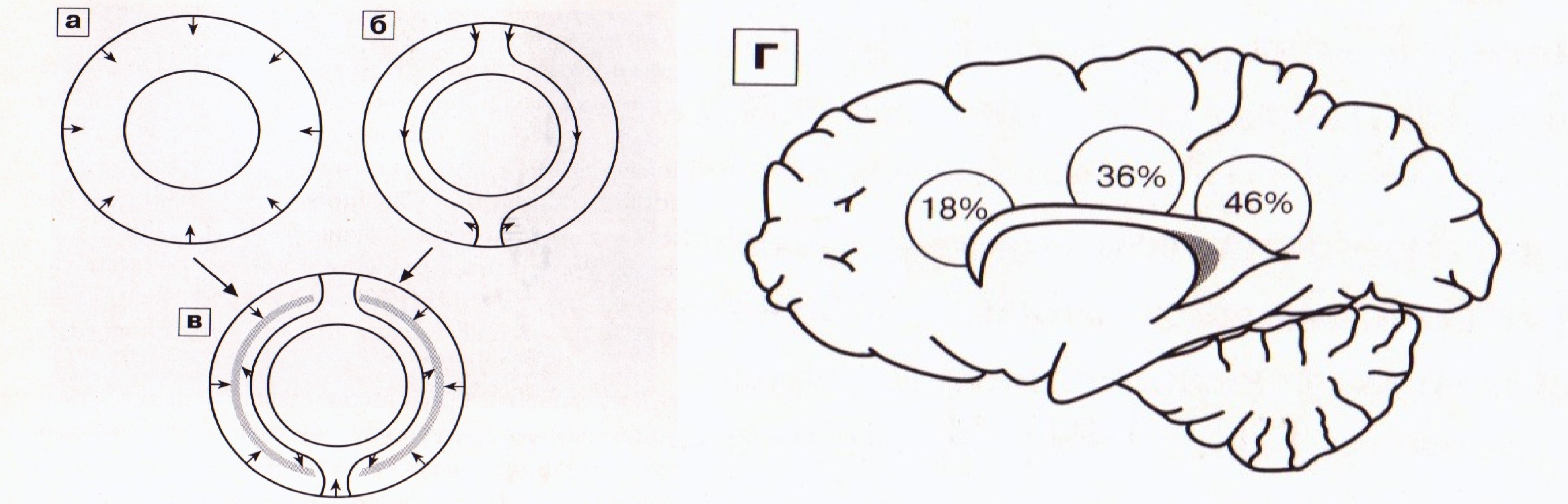
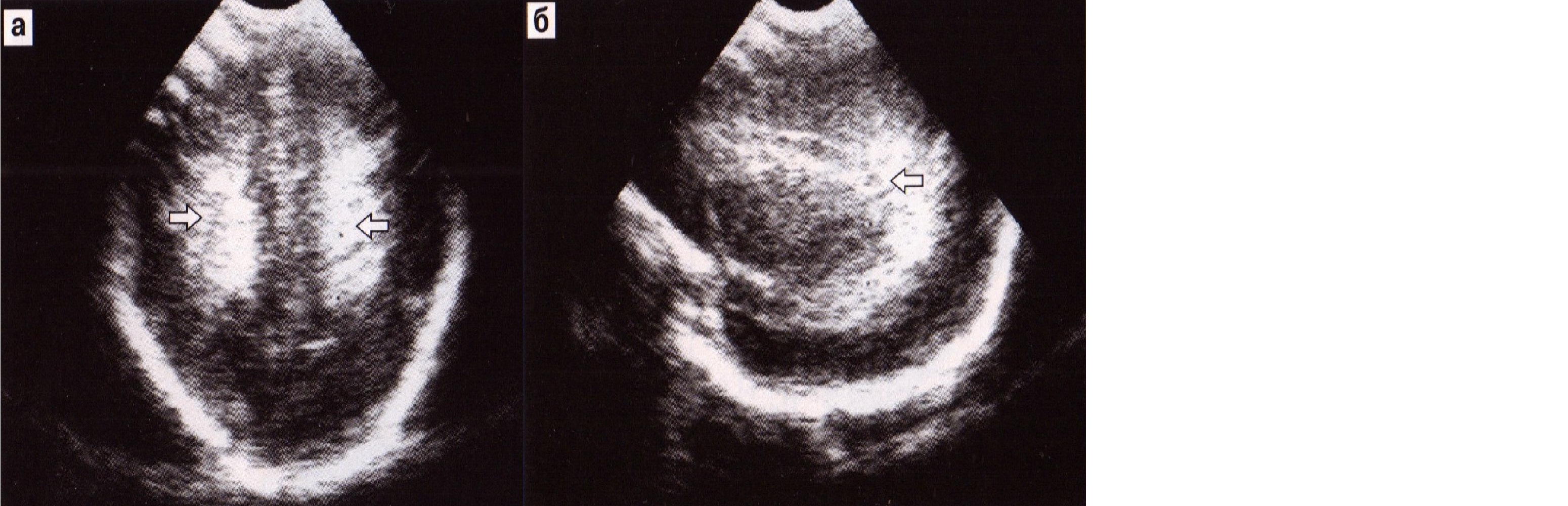
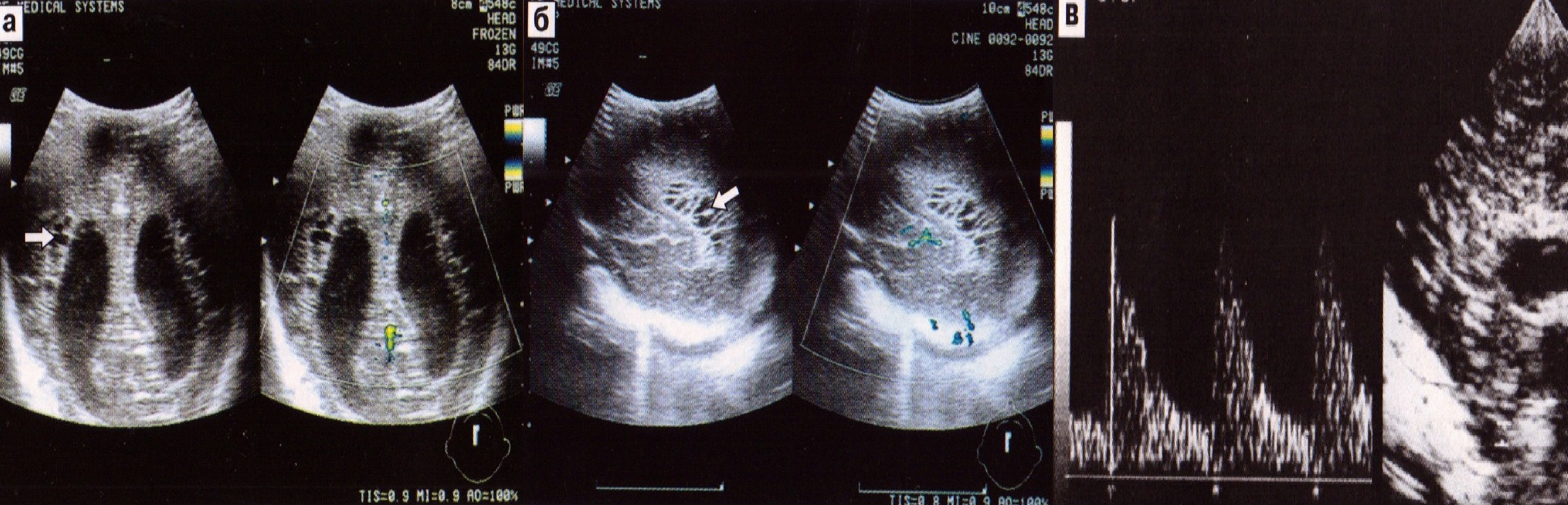
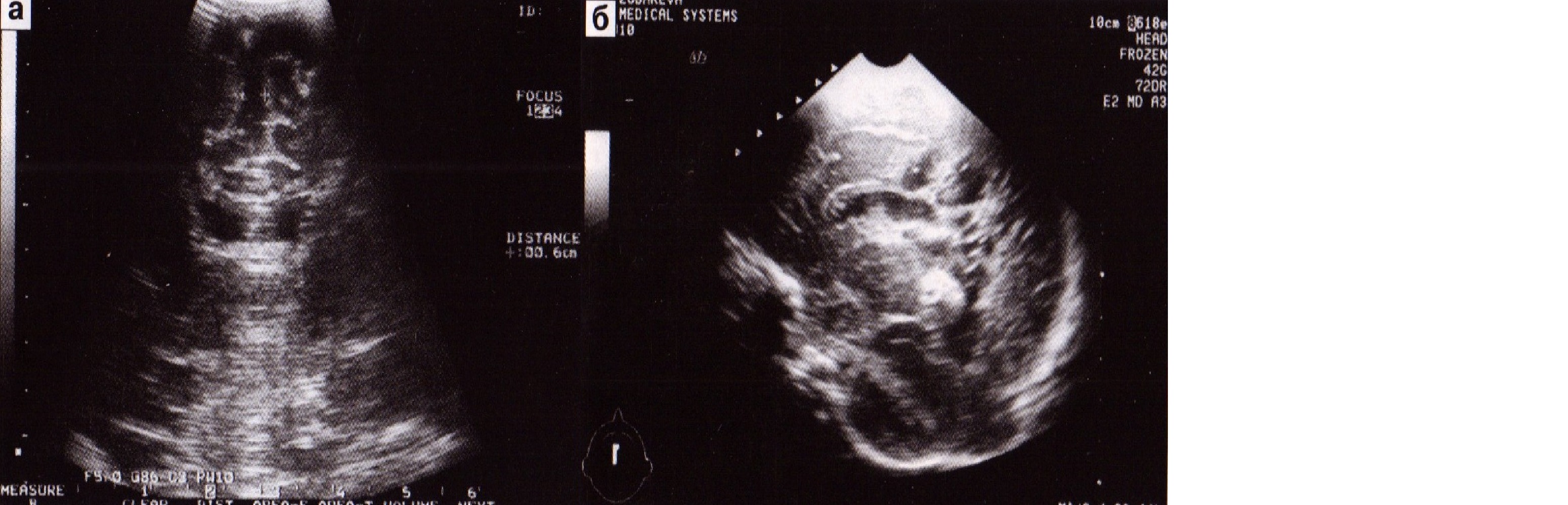
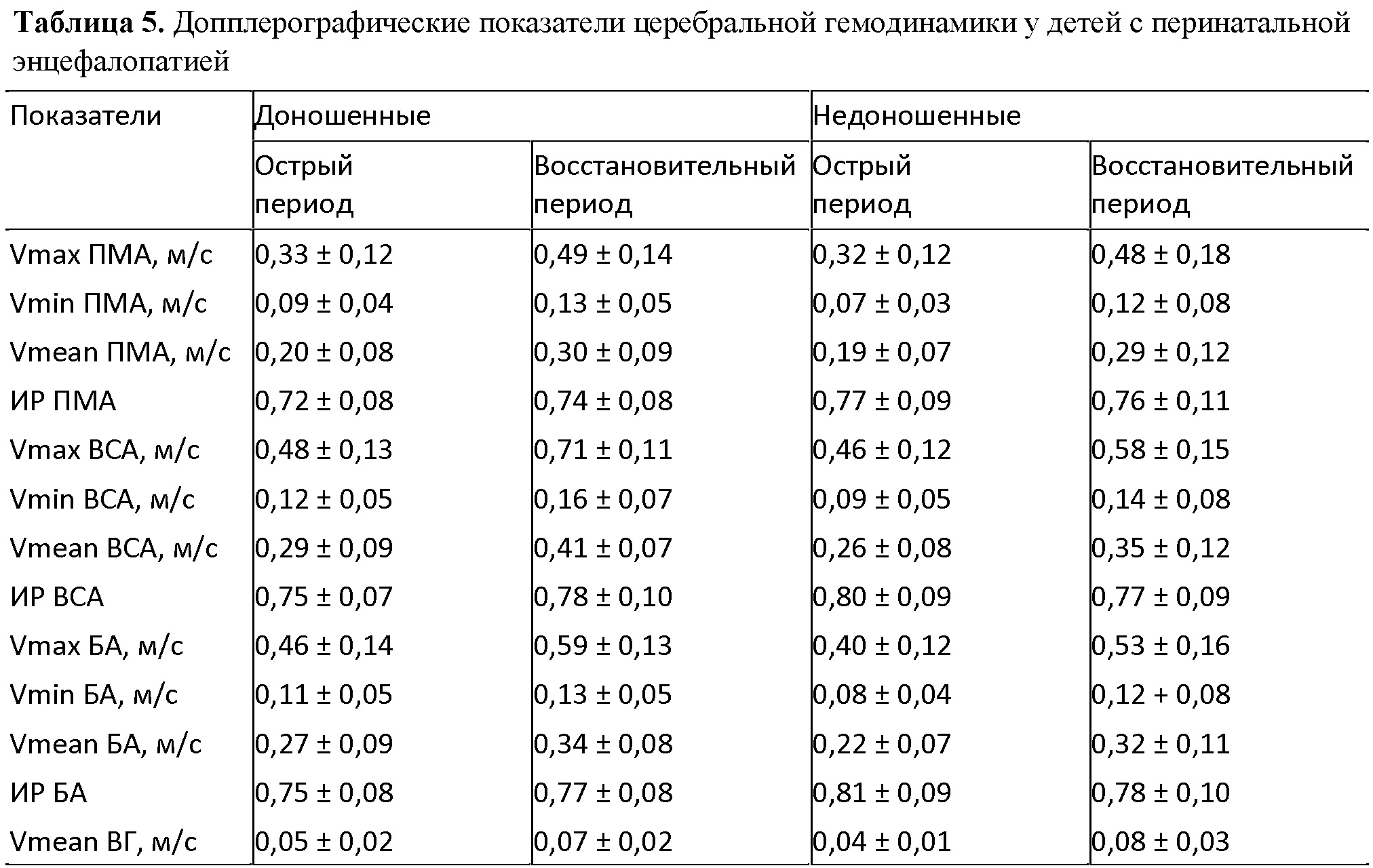
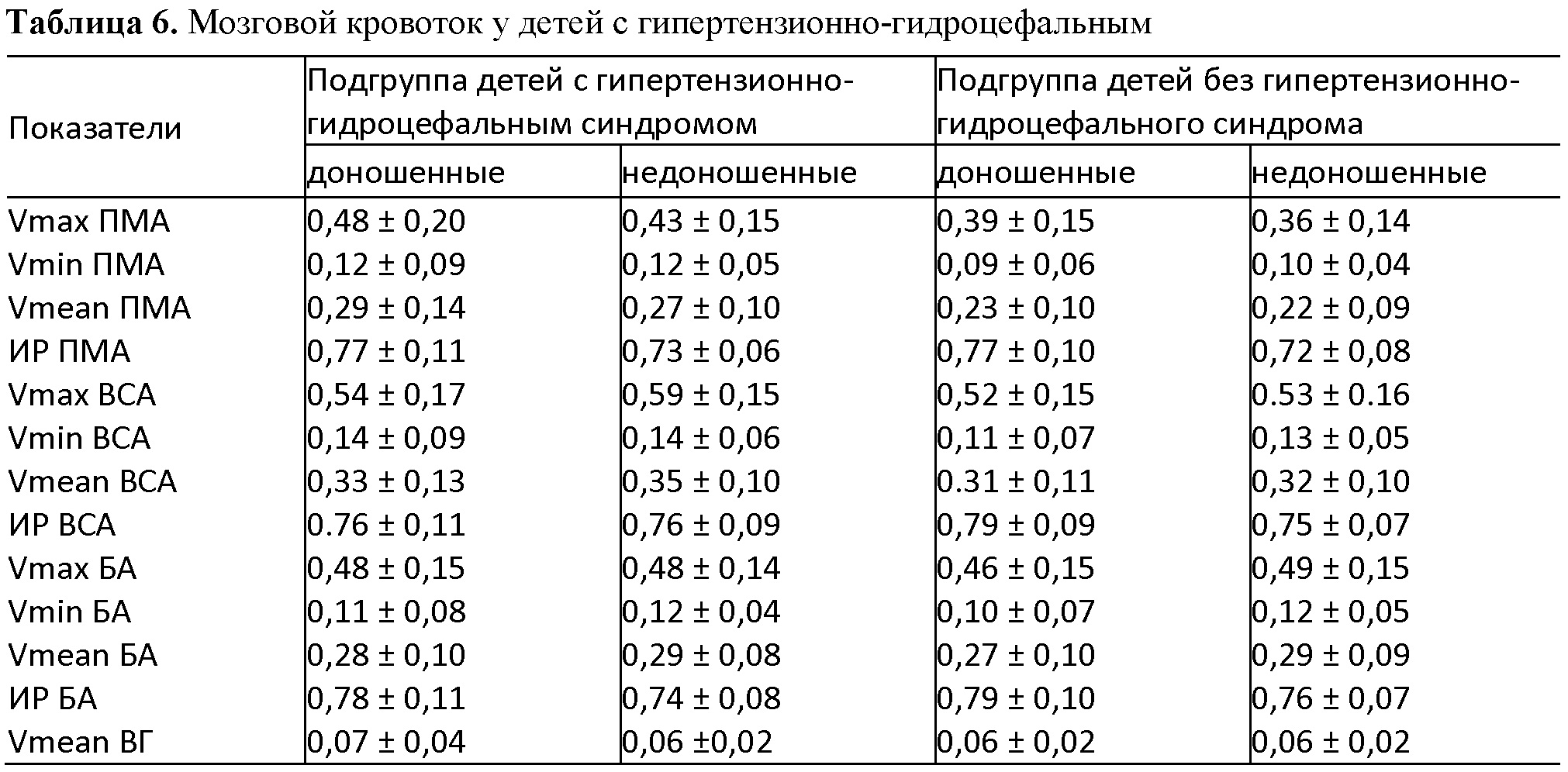
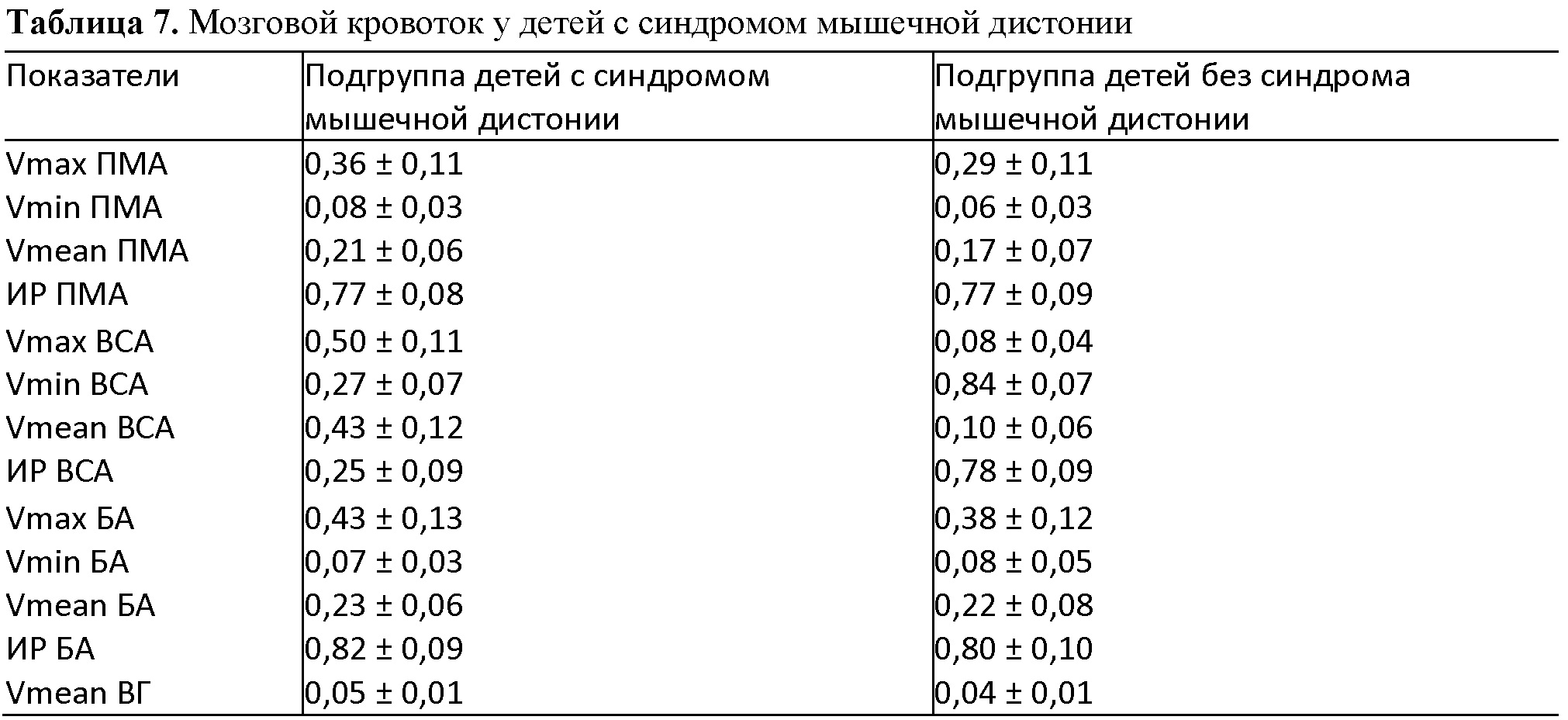

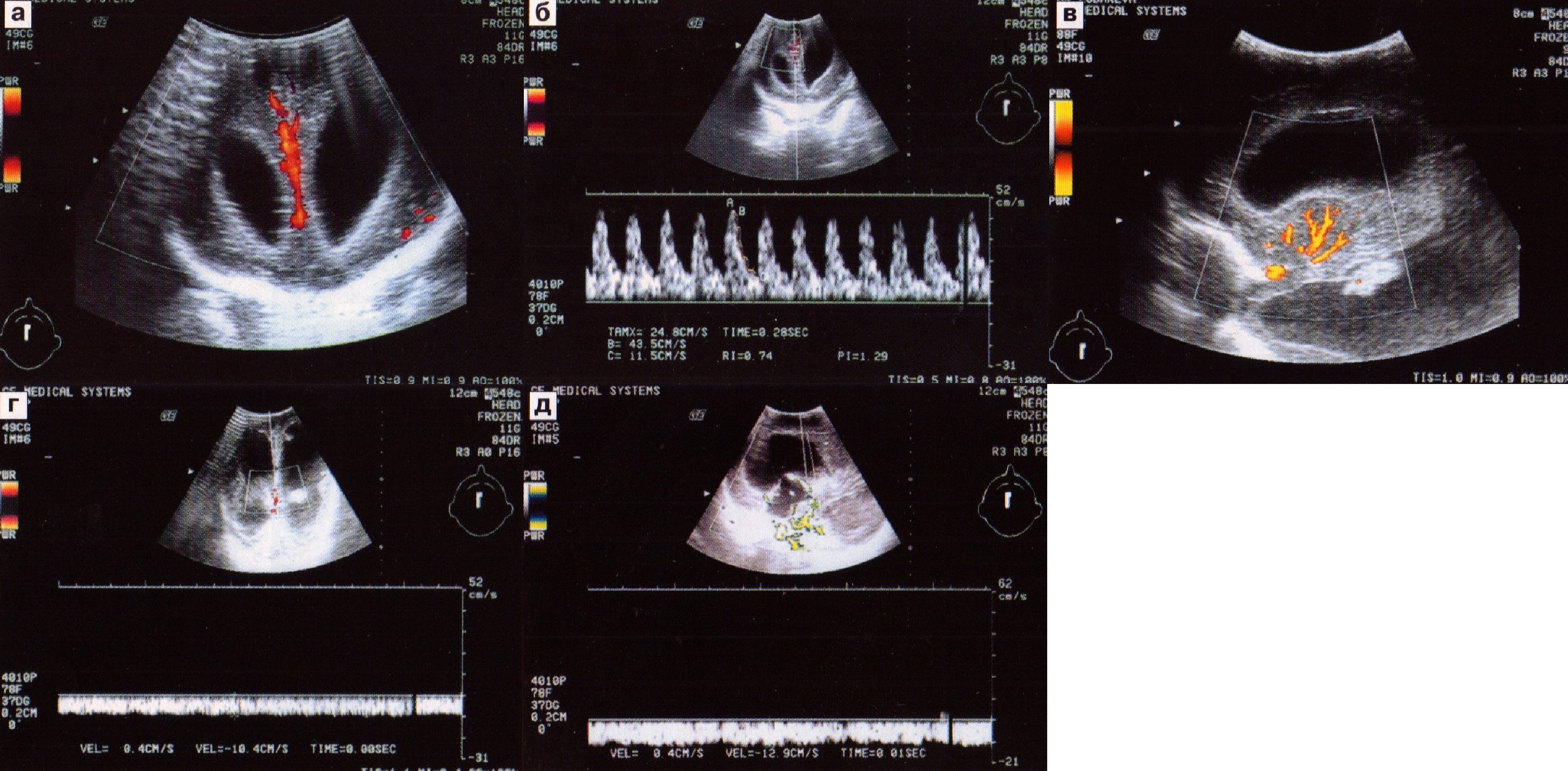

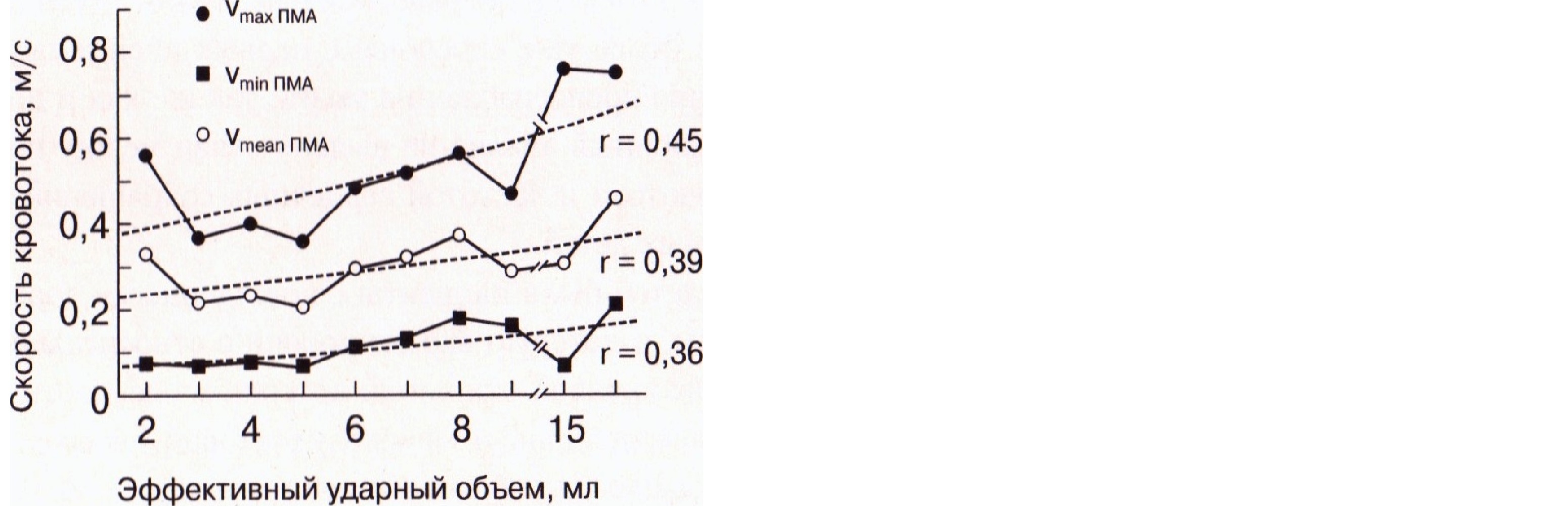
Значит ИР повышен при гидроцефалии и ПВЛ ?