Аортальный стеноз на Эхо-КГ
Поражение аортального клапана является наиболее частым пороком клапанов сердца в развитом мире [1]. В частности, кальцифицированный стеноз аорты является причиной значительной заболеваемости и смертности [2]. Когда-то считалось, что стеноз аорты (СА) связан с простым «износом» в результате старения, но все больше понимается, что это строго регулируемый процесс, имеющий некоторое сходство с атеросклерозом. Считается, что исходное событие вызывает повреждение эндотелия, инфильтрацию воспалительных клеток и инициирование кальцификации. Затем происходит прогрессирующий цикл отложения кальция в створках клапана, ведущий к неумолимому маршу к тяжелому стенозу аорты и развитию симптомов и сердечной недостаточности, если не выполняется замена аортального клапана (AVR).
Стеноз аорты приводит к избыточному давлению в левом желудочке, что приводит к гипертрофии левого желудочка (ГЛЖ), которая нормализует напряжение стенки в соответствии с законом Лапласа. Первоначально это адаптивно, но в конечном итоге наступает декомпенсация, приводящая к развитию сердечной недостаточности, симптомов и побочных эффектов. Текущие клинические рекомендации предлагают клапанное вмешательство при тяжелом стенозе аорты, когда есть доказательства декомпенсации ЛЖ, на что указывает развитие либо симптомов, либо нарушения фракции выброса ЛЖ (ФВ) [5, 6]. Однако оценка симптомов у пожилых пациентов, которые часто имеют множественные сопутствующие заболевания, может быть сложной задачей, в то время как нарушение систолической функции ЛЖ происходит на поздних стадиях заболевания [7] и часто является необратимым [8, 9]. Следовательно, существует потребность в более объективной оценке декомпенсации левого желудочка.
Допплеровская эхокардиография предоставляет информацию о гемодинамике аортального клапана, которая недоступна при использовании других методов визуализации. Простые оценки как пиковой, так и средней скорости через аортальный клапан (рис. 1) используются для расчета градиентов пикового и среднего давления с использованием модифицированной формулы Бернулли, а также площади аортального клапана (AVA) с использованием уравнения непрерывности. Последний не зависит от потока и поэтому часто важен для точности диагностики, особенно в состояниях с низким расходом [10]. Текущие рекомендации рекомендуют градуировать гемодинамическую тяжесть стеноза аорты на основе комбинированной информации, предоставляемой пиковой скоростью (AV Vmax), средним градиентом и площадью аортального клапана [5, 6].
Хотя этот комбинированный подход эффективен для большинства пациентов, он приводит к широкому спектру диагностических категорий и потенциальной клинической путанице. Все больше ценятся и другие потенциальные ограничения эхокардиографии. Во-первых, у некоторых пациентов может оказаться невозможным получение диагностических акустических окон, так же как и точное совмещение допплеровского датчика с направлением максимального кровотока через клапан. В обоих случаях будут внесены ошибки измерения. Во-вторых, при эхокардиографии могут возникнуть трудности с точным измерением диаметра выходного тракта левого желудочка (LVOT): это ключевой компонент при использовании уравнения непрерывности для расчета площади аортального клапана. Действительно, эхо часто недооценивает диаметр LVOT из-за кальцификации или его эллиптической формы, и когда измерение возводится в квадрат, даже небольшие ошибки значительно увеличиваются. Уравнение непрерывности также основывается на нескольких геометрических предположениях, которые часто не выполняются при стенозе аорты (например, круговой тракт оттока и профиль ламинарного потока), что вносит дополнительную ошибку. Наконец, существуют внутренние несоответствия в порогах тяжести, установленных в клинических руководствах. АВА 1,0 см2 чувствительна, но менее специфична для тяжелого стеноза аорты и фактически соответствует среднему градиенту давления 30–35 мм рт. Ст. [11], а не рекомендованному пороговому значению 40 мм рт. Ст. [5, 6]. Это частично может объяснить, почему от 20 до 30% пациентов с умеренным или тяжелым стенозом аорты имеют противоречивые оценки тяжести заболевания в зависимости от оцениваемого эхокардиографического маркера [4, 12].
Функция и масса ЛЖ
Фракция выброса ЛЖ, полученная с помощью эхокардиографии, используется в клинических рекомендациях для отражения систолической функции ЛЖ. Нарушение ФВ ниже 50% является показанием к вмешательству на клапане, поскольку у этих пациентов плохой исход без операции [8, 13]. Однако снижение фракции выброса является нечувствительным показателем систолической дисфункции ЛЖ при наличии концентрического ремоделирования и гипертрофии. Действительно, примерно у трети пациентов со стенозом аорты и нормальной ФВ имеются достоверные доказательства систолического нарушения ЛЖ при оценке другими методами [14]. Эти альтернативные маркеры включают глобальные измерения продольной деформации, которые, как было показано, имеют прогностическое значение у пациентов с тяжелым стенозом аорты и нормальной фракцией выброса [15].
У пациентов со стенозом аорты неизменно развивается гипертрофия левого желудочка, поскольку ЛЖ реконструируется для нормализации напряжения стенки. Степень, в которой это происходит, плохо коррелирует с гемодинамической тяжестью стеноза и является независимым предиктором исходов [16, 17 •]. Поэтому гипертрофический ответ ЛЖ следует оценивать отдельно. Геометрия концентрического ремоделирования [18] и тяжелая ГЛЖ [19] были связаны со смертностью после замены клапана, в то время как увеличение массы ЛЖ связано с сердечно-сосудистыми заболеваниями и смертностью у пациентов с бессимптомным тяжелым АС [17 •]. Важно отметить, что недавние данные, полученные от 1656 пациентов в исследовании SEAS, показали, что индекс массы ЛЖ является независимым предиктором сердечно-сосудистых событий и смертности от всех причин [20].
Подтипы с низким расходом и низким градиентом
Наиболее сложные пациенты — это пациенты с дискордантными параметрами тяжести, наиболее часто характеризующимися низкой AVA и низким трансклапанным градиентом. Как уже говорилось, этому есть несколько возможных объяснений, включая погрешность измерения и внутренние несоответствия в нормативных пороговых значениях. Однако у многих пациентов несоответствие будет вызвано не ошибкой, а скорее отражением состояния низкого потока, связанного с множеством различных факторов. Низкий поток обычно определяется индексом ударного объема (SV) <35 мл / м2, хотя это пороговое значение является несколько произвольным.
Классический низкопроточный низкоградиентный AS
У пациентов с тяжелым стенозом аорты и систолической дисфункцией ЛЖ ударный объем невелик из-за снижения сократимости миокарда. Как следствие, градиент, создаваемый над аортальным клапаном, относительно невелик (средний градиент <40 мм рт. Ст.), Но площадь клапана мала <1,0 см2 (низкий градиент потока с пониженным ФВ, тяжелый АС). Важно дифференцировать это состояние от «псевдотяжелого АС», когда желудочек сильно поврежден из-за альтернативной патологии до такой степени, что он не может генерировать достаточный поток для полного открытия аортального клапана. Стресс-эхокардиография (ДСЭ) с низкими дозами добутамина, рекомендованная в клинических руководствах [5, 6], может различать эти состояния; если средний градиент клапана увеличивается до> 40 мм рт. ст. (или AV Vmax> 4 м / с), а площадь клапана остается <1,0 см2 при нагрузке на добутамин, то определяется тяжелый АС. Эти пациенты имеют относительно низкую операционную смертность (5–7% [21, 22]) и получают пользу от АРК [23].
Резерв потока
Те пациенты, которым не удалось увеличить свой градиент с помощью стресс-эхокардиографии, вероятно, не имеют или имеют пониженный «резерв кровотока», который определяется как увеличение ударного объема менее чем на 20% [24]. Эта группа пациентов имеет значительно более высокую операционную летальность (22–30% [13, 21]), но у тех, кто выжил после AVR, результаты (улучшение EF и смертности) аналогичны таковым с резервом кровотока [13, 25] и улучшенным прогнозом. по сравнению с аналогичными пациентами, леченными медикаментозно [13]. В будущем роль транскатетерной имплантации аортального клапана (TAVI) в этой группе может возрасти, учитывая их высокий операционный риск.
Парадоксальный низкопроизводительный низкоградиентный AS
У этих пациентов низкий кровоток в контексте сохраненной фракции выброса, что снова приводит к картине сниженной AVA (<1,0 см2) и низкого среднего градиента (<40 мм рт. Ст.). Его часто называют нормальным ФВ с низким потоком и низким градиентом или парадоксальным стенозом аорты с низким потоком и низким градиентом, и он был впервые выявлен в 2007 году [26]. Как правило, это пациенты женского и пожилого возраста, у которых небольшая гипертрофированная полость ЛЖ является причиной низкого ударного объема. Недавний метаанализ 7459 пациентов и другие исследования показали, что смертность в этой группе увеличивается [26, 27, 28, 29] и снижается при вмешательстве клапана [28–31]. Однако это не наблюдалось во всех исследованиях [32]. Стресс-эхокардиография бесполезна для этих пациентов, поскольку они часто проявляют ограничительную физиологию из-за диастолической дисфункции, ограничивающей любое увеличение SV; однако оценка кальция на КТ аортального клапана может помочь в различении [12]. Текущие клинические руководства рекомендуют вмешательство аортального клапана в этой группе, если у пациента есть симптомы и врач считает, что обструкция клапана является наиболее вероятной причиной симптомов на основании вышеуказанных параметров [5, 6].
Нормальный поток с низким градиентом AS
Пациенты с низким уровнем AVA и низким средним градиентом в контексте сохраненной EF и нормального кровотока являются обычными [27], но относятся к признанной группе, которая не представлена в клинических руководствах. Хотя это неоднородная группа, которая включает ошибки измерения, малый размер тела или несоответствия в клинических рекомендациях [11], значительная часть пациентов страдает тяжелым АС [12], а АВР, по-видимому, улучшает выживаемость [31]. Недавний крупный метаанализ продемонстрировал, что у этих пациентов исходы аналогичны высокоградиентному тяжелому АС, который улучшается за счет ЗАК [27]. Требуются дальнейшие исследования в этой области.
Безразмерный индекс
Безразмерный индекс скорости — это не зависящая от потока переменная, вычисляемая путем деления интеграла скорости-времени LVOT (VTI или Vmax) на AV VTI (или Vmax) без необходимости измерения диаметра LVOT. Коэффициент <0,25 указывает на тяжелый стеноз и особенно полезен, когда измерение LVOT затруднено или в случаях непоследовательной классификации.
Расширенная эхокардиография
Помимо демонстрации резерва кровотока при тяжелом АС с низким потоком и низким градиентом с пониженной фракцией выброса, стресс-эхокардиография также улучшает прогноз при бессимптомном высокоградиентном тяжелом АС, когда средний градиент увеличивается на> 20 мм рт. Ст. При физической нагрузке. прогнозирует больший риск развития симптомов и нежелательных явлений [34, 35].
Чреспищеводная эхокардиография (ЧЭ) может быть полезна при стенозе аорты с планиметрией AVA, используемой в качестве альтернативного метода измерения степени тяжести стеноза аорты. Хотя планиметрия остается сложной на 2D-изображениях из-за обширной кальцификации и трудностей с обеспечением положения на кончиках створок, это кажется более выполнимым на 3D TOE. В исследовании 307 пациентов с тяжелым стенозом аорты сравнивали планиметрию клапана с использованием 3D TOE с областью аортального клапана, полученной с помощью TTE. Они показали, что планиметрия клапана была возможна у 92% пациентов (у 8%, где это было невозможно, это было связано с серьезной кальцификацией) и что два измерения показали хорошую корреляцию (r = 0,85). Тем не менее, плановые измерения AVA были стабильно выше, чем рассчитанные по уравнению неразрывности [36]. Таким образом, оценка тяжести заболевания с помощью планиметрии может быть затруднена, хотя в этом контексте AVA <1,0 см2 является убедительным признаком тяжелого стеноза аорты и потенциально полезным арбитром в случаях диагностической неопределенности.
TOE также предлагает точную оценку размеров корня и кольца аорты и часто выполняется перед операцией перед операцией на аортальном клапане. Аналогичные измерения могут быть выполнены с помощью компьютерной томографии, и методы, используемые в разных центрах, различаются. Использование интраоперационной ТОЭ является обычным делом во многих кардиоторакальных центрах, где она позволяет точно оценить анатомию и оптимизировать гемодинамику перед установлением искусственного кровообращения. После процедуры ТОЭ может подтвердить удовлетворительную функцию клапана, стабильную гемодинамику и исключить такие осложнения, как обструкция выводного тракта. Ряд обсервационных исследований показывают, что интраоперационные изменения в лечении ТОЭ у 11–18% пациентов могут улучшить исход [37, 38] и могут быть рентабельными [39]. Интраоперационная ТОЭ имеет рекомендацию класса lla из последнего обновления рекомендаций CC / AHA / ASE 2003 г. по клиническому применению эхокардиографии.
Предварительная визуализация (TOE или CT) важна до TAVI для обеспечения правильного размера протеза, а внутрипроцедурная TOE в реальном времени часто используется для помощи в определении размеров и позиционирования устройства [40, 41], хотя это ограничено — апикальный и аортальный доступы, когда пациент находится под общим наркозом. Исследования противоречивы, но предполагают, что в целом наблюдается небольшое завышение площади фиброзного кольца при КТ и занижение при ТОЭ [42, 43]. 3D TOE превосходит 2D TOE и предлагает результаты, аналогичные CT в некоторых исследованиях [44].
Кальцификация клапанов
Хотя механизмы, лежащие в основе кальцификации клапанов, остаются не до конца определенными [3], ее важность для прогрессирования заболевания и побочных эффектов впервые была выявлена в основополагающих исследованиях Rosenhek и его коллег [45, 46]. 126 пациентов с бессимптомным тяжелым стенозом аорты находились под наблюдением в течение 22 ± 18 месяцев. Кальцификацию аортального клапана измеряли по четырехбалльной порядковой шкале, при этом умеренная или тяжелая кальцификация (оценка 3 или 4) являлась единственным независимым предиктором AVR или летальности, превосходя показатели гемодинамики по степени тяжести. Значительная кальцификация клапана также связана с более быстрым прогрессированием заболевания, потребностью в ЗАК и смертностью от всех причин у пациентов со стенозом от легкой до умеренной степени [46]. В то время как тяжелая кальцификация аортального клапана считается показанием для АРК у бессимптомных пациентов с тяжелым АС, этот метод на практике трудно применять из-за плохого согласия наблюдателей относительно степени кальцификации [47].
CT
Оценка кальция на КТ
Кальциевую нагрузку в аортальном клапане можно более точно определить количественно с помощью электрографически управляемой неконтрастной компьютерной томографии (КТ). Затем показатель кальция CT аортального клапана может быть измерен с помощью шкалы Agatston (AU), которая учитывает как плотность, так и объем измеренного CT кальция и тесно коррелирует с массой кальция в эксплантированных аортальных клапанах [47]. Оценка кальция при КТ аортального клапана продемонстрировала отличную воспроизводимость результатов сканирования и повторного сканирования внутри и между наблюдателями [47, 48] и тесно коррелирует с эхокардиографическими показателями гемодинамической тяжести [47–49]. Важно отметить, что недавние данные продемонстрировали, что кальциевая шкала КТ аортального клапана обеспечивает надежное предсказание прогрессирования заболевания и прогноза [50–52].
Пороговые значения серьезности
Пороговые значения кальциевой шкалы КТ для дифференциации умеренного от тяжелого стеноза аорты были недавно предложены в исследовании 451 пациента с согласованной степенью тяжести АС на эхокардиографии и сохраненной фракцией выброса. Интересно, что они были разными для мужчин и женщин (≥2065 AU для мужчин и ≥1274 AU для женщин) даже после индексации площади кольца аорты (≥476 AU / см2 для мужчин и ≥292 AU / см2 для женщин). Эти пороговые значения затем были применены к более широкой когорте из 794 пациентов и продемонстрировали сильную прогностическую ценность для смертности от всех причин с возрастающей значимостью эхокардиографических параметров фракции выброса и тяжести стеноза [53 ••] (рис. 2).
Оценка кальция на аортальном клапане может быть особенно полезна в случаях низкого градиента кровотока с пониженным EF [49, 54], особенно при отсутствии резерва кровотока [47], когда может быть сложно определить степень тяжести только с помощью эхокардиографии. Требуется дальнейшая работа для оценки достоверности этих пороговых значений в альтернативных популяциях пациентов и подтверждения их прогностической ценности. Если это подтвердится, мы полагаем, что оценка кальция на КТ станет клинически полезным и независимым от потока адъювантом к стандартной эхокардиографии.
Улучшенный расчет AVA
Все более широкое использование КТ-ангиографии для определения размера клапана перед процедурами TAVI показало, что LVOT часто бывает эксцентрической, а не круглой. Действительно, недавнее исследование 269 пациентов с тяжелым АС, перенесших КТ, показало, что ВТЛЖ эксцентрична у 93% пациентов [55]. Как следствие, измерения TTE диаметра LVOT часто могут привести к недооценке истинной AVA [56]. Таким образом, использование CT, CMR или 3D-эхо для планирования области LVOT может повысить точность вычислений AVA.
ПЭТ
ПЭТ — это новый метод визуализации, который позволяет измерять активность конкретных болезненных процессов in vivo. Недавно в этом методе использовались два индикатора для измерения воспаления (18F-фтордезоксиглюкоза (18F-FDG)) и кальцификационной активности (18F-фторид) в клапанах пациентов со стенозом аорты. Затем гибридные сканеры ПЭТ / КТ позволяют сравнивать активность этих двух ключевых процессов с наличием установленных областей макрокальцификации на КТ.
18F-фторид
18F-фторид использовался в качестве индикатора костной ткани в течение 50 лет, связываясь с кристаллом гидроксиапатита и обнаруживая области повышенной костной активности. В сосудистой сети он связывается преимущественно с областями вновь развивающегося микрокальцификации, потому что площадь поверхности гидроксиапатита в этих нанокристаллических областях является максимальной. Напротив, в областях макрокальцификации большая часть гидроксиапатита интернализована и недоступна для связывания [57]. При стенозе аорты 18F-фторид действует как маркер активности кальцификации, коррелирующей с гистологическим окрашиванием на щелочную фосфатазу (r = 0,65) и остеокальцин (r = 0,68) [52], и предсказывает, где будут формироваться новые области макроскопического кальция (рис. . 3). Поглощение индикаторов увеличивается при более позднем стенозе аорты [58], дает надежный прогноз прогрессирования заболевания через 1 и 2 года, имеет небольшую дополнительную ценность для компьютерной томографии [52, 59] и действует как независимый предиктор неблагоприятных клинических событий [59] . Этот метод является многообещающим для лучшего понимания роли кальцификации при стенозе аорты, например, недавнее исследование ПЭТ показало, что, хотя активность кальцификации при стенозе аорты выше, чем воспаление, обратное верно для атеросклероза, что потенциально объясняет различные эффекты статинов в эти два условия [60]. При дальнейшем улучшении ПЭТ с 18F-фторидом может доказать свое клиническое применение для выявления пациентов, которые могут быстро перейти к хирургическому вмешательству, и в качестве маркера активности заболевания и конечной точки эффективности в клинических испытаниях новых методов лечения (например, SALTIRE 2: NCT02132026).
8F-FDG
ПЭТ с 18F-FDG широко используется для визуализации воспаления сосудов. Этот ПЭТ-индикатор представляет собой аналог глюкозы, который накапливается в метаболически активных клетках, таких как макрофаги сосудов. Действительно, наблюдалась отличная корреляция между нагрузкой макрофагами на гистологию (окрашивание на CD68 при иммуногистохимии) в атероме сонной артерии [61] и сигналом 18F-FDG. При стенозе аорты активность 18F-FDG выше у пациентов по сравнению с контрольной группой, демонстрируя умеренную корреляцию с тяжестью порока клапана сердца [58]. Интересно, что не наблюдали корреляции с окрашиванием эксплантированных клапанов CD68, что позволяет предположить, что поглощение 18F-FDG происходит в других метаболически активных клетках, хотя это исследование было ограничено небольшим размером выборки [52]. Возможно, самым большим ограничением этого метода является эффект физиологического поглощения 18F-FDG миокардом, который часто загрязняет сигнал, исходящий от аортального клапана.
CMR
Кардиомагнитный резонанс — это новая технология, которая предлагает отличное пространственное разрешение, функциональную оценку и уникальную возможность характеризовать ткань миокарда. Однако это остается дорогостоящим методом с ограниченной доступностью для кардиологических пациентов в большинстве центров.
Масса и гипертрофия ЛЖ
CMR обеспечивает золотой стандарт оценки объемов и массы ЛЖ и позволяет детально исследовать как степень гипертрофии, так и различные паттерны адаптации левого желудочка. Важно отметить, что гипертрофический ответ миокарда слабо коррелирует с гемодинамической тяжестью стеноза аорты [16, 62, 63], при этом у мужчин обычно наблюдается большее увеличение массы ЛЖ даже после поправки на размер тела [16]. Обычно утолщение стенки происходит концентрическим образом, но недавние исследования показали, что асимметричный рисунок также существует примерно у четверти пациентов, оцениваемых методом CMR [16]. Клиническая важность этого наблюдения остается неясной.
Фиброз миокарда
Фиброз миокарда является ключевым механизмом, приводящим к прогрессированию гипертрофии левого желудочка до сердечной недостаточности и смерти при стенозе аорты [64]. Исторически это оценивалось только при использовании методов инвазивной эндомиокардиальной биопсии, но это связано с небольшим, но значительным риском осложнений [65] и подвержено ошибкам выборки. CMR обеспечивает неинвазивную оценку фиброза всего сердца с использованием двух методов: позднего увеличения гадолиния (LGE) и картирования T1 (рис. 4).
LGE
Этот метод был впервые описан в 1999 г. [66] и включает внутривенное введение контрастных веществ на основе гадолиния (GBCA). Эти агенты изменяют значения T1 миокарда и попадают в здоровый миокард из пула крови вниз по градиенту концентрации в течение 1–3 минут (фаза промывки). Затем почечная экскреция GBCA из пула крови вызывает обратный градиент концентрации с уменьшением концентрации GBCA в миокарде в течение последующих 10–30 минут (фаза вымывания). Большой молекулярный размер гадолиния не позволяет GBCA пересекать клеточные мембраны, так что они эффективно маркируют внеклеточное пространство и накапливаются в областях замещающего фиброза из-за замедленного вымывания [67]. Эти фокусные области затем можно обнаружить с помощью T1-взвешенных последовательностей через 15–20 минут после введения контраста. При стенозе аорты участки замещающего фиброза выглядят как светлые участки в средней стенке левого желудочка в отличие от окружающего здорового миокарда [68]. Области перенесенного инфаркта миокарда, которые часто встречаются у пациентов с АС, также выявляются этим методом, но их можно дифференцировать от фиброза замещения средней стенки по их субэндокардиальному / трансмуральному паттерну и коронарному распределению.
Замещающий фиброз средней стенки, определяемый методом LGE, часто встречается при стенозе аорты (29–62% пациентов в зависимости от исследуемой популяции [69, 70 •, 71 •]) и кажется необратимым после вмешательства на клапане [72]. Наличие LGE коррелирует с гистологическим фиброзом [73 •] и признаками повреждения миокарда (что измеряется с помощью концентраций тропонина I высокой чувствительности) [74]. При выраженном фиброзе средней стенки выявляются пациенты, у которых не наблюдается улучшения систолической функции ЛЖ [73 •] или общего функционального статуса после ЗАК [72]. Важно отметить, что три исследования подтвердили, что присутствие LGE действует как независимый предиктор смертности от всех причин [70 •, 71 •, 73 •], увеличивая риск смерти до восьми раз [70 •]. Таким образом, фиброз средней стенки, по-видимому, является прямым маркером декомпенсации левого желудочка при стенозе аорты и может быть полезен при выявлении пациентов, у которых желудочек начинает отказывать, и которым может быть полезна быстрая AVR. Необходимы дальнейшие исследования в этой области; действительно, EVoLVeD-AS — многоцентровое рандомизированное контролируемое исследование, оценивающее пользу раннего хирургического вмешательства у пациентов с развитым аортальным стенозом и фиброзом средней стенки при CMR, — должно начать набор пациентов в следующем году.
Диффузный фиброз
Неинвазивная оценка диффузного фиброза более сложна. Его гомогенный характер означает, что его упускают из виду методы LGE, которые полагаются на области нормального миокарда для создания контраста. Однако обнаружение диффузного фиброза важно, поскольку широко считается, что он обратим [75] и является предшественником необратимых форм замещающего фиброза.
Методы картирования миокарда T1 позволяют рассчитать конкретное время релаксации T1 (собственный T1) для каждого вокселя CMR, которое затем может быть отображено на двухмерной карте с наложением цветов для облегчения визуального анализа. Было разработано несколько различных методов (таблица 1). Полное изучение этих методов выходит за рамки данной статьи, но дополнительную информацию можно найти в этом недавнем обзоре Moon et al. [76]. Короче говоря, измерения нативного Т1 могут быть выполнены без необходимости контрастирования, что является важным потенциальным преимуществом, особенно у пациентов с тяжелой почечной дисфункцией, которые подвержены риску индуцированного контрастом нефрогенного системного фиброза (NSF) [77]. GBCA также можно использовать для создания пост-контрастных карт T1, поскольку гадолиний сокращает время релаксации T1. В принципе, эти изображения обеспечивают больший сигнал, но на них влияют индивидуальные вариации кинетики гадолиния, и они страдают от плохой воспроизводимости при изучении в популяциях AS [78 •]. Важно отметить, что эти вариации кинетики можно исправить, используя несколько подходов. Коэффициент распределения (λ) рассчитывается как отношение значений Т1 после контрастирования миокарда и крови, что улучшает воспроизводимость и корректирует многие искажающие факторы. При равновесии контраста гадолиния концентрация контраста в крови и миокарде должна быть одинаковой. Расчет объема распределения крови (1 — гематокрит) позволяет вывести объем распределения миокарда, также называемый фракцией внеклеточного объема (ECV). Поскольку ECV преимущественно содержит коллаген и увеличивается при фиброзных состояниях, он действует как маркер фиброза миокарда, тесно коррелируя с объемной долей коллагена на гистологии [79–82].
Хотя нативный T1 и ECV были широко изучены в литературе, результаты неоднозначны, и интерпретация затруднена из-за гетерогенных изученных популяций, вариаций в последовательности картирования T1, сканера CMR, напряженности магнитного поля и аналитических методов (например, включение или исключение областей LGE) .
Исходные значения T1, по-видимому, коррелируют с гистологическим фиброзом миокарда [83, 84], а также с общей продольной деформацией [84], массой ЛЖ, гемодинамическими оценками тяжести и функциональным статусом пациента [83]. Однако его способность отличать здоровых пациентов от контрольной зависит от исследуемой популяции [78, 83] со значительной степенью совпадения значений T1 между этими группами, особенно у пациентов с менее выраженным стенозом. Недавно было показано, что в популяции пациентов с неишемической дилатационной кардиомиопатией нативный T1 является независимым предиктором смертности от всех причин и событий сердечной недостаточности [85], хотя это не было продемонстрировано у пациентов со стенозом аорты.
ECV
Фракция внеклеточного объема используется в качестве заменителя внеклеточного пространства, которое расширяется за счет отложения коллагена при диффузном фиброзе. Наш центр продемонстрировал превосходную вариабельность стеноза аорты в пределах и между наблюдателями и при повторном сканировании по сравнению с другими показателями T1, а ECV коррелирует с диастолической дисфункцией ЛЖ [78 •] и функциональным статусом [86]. Однако в настоящее время прогностических данных нет. Также имеется значительное совпадение между значениями ECV, полученными у здоровых добровольцев и пациентов с АС, и нормальные значения ECV наблюдались в популяции с гипертонией (другое состояние, характеризующееся перегрузкой давлением ЛЖ) [87].
Другой недостаток заключается в том, что ECV измеряет фиброз относительно объема (или массы) левого желудочка. Поэтому сбалансированное увеличение как массы ЛЖ, так и диффузного фиброза с прогрессирующим стенозом аорты при использовании этого подхода не обнаруживается. Фактически, важное исследование Krayenbeuhl et al. Последовательные биопсии миокарда показали, что гистологический фиброз миокарда в процентах от миокарда (который оценивается расчетом ECV на CMR) фактически увеличивался на ранних этапах после операции на аортальном клапане в результате значительного уменьшения массы ЛЖ без изменения степени фиброза. Однако общее фиброзное содержание (которое можно оценить по CMR по объему фиброза; ECV × конечный диастолический объем миокарда) в конечном итоге снизилось на более поздней стадии (повторная биопсия в среднем через 70 месяцев после AVR) [75]. Это частично подтверждается недавним исследованием CMR, которое показало, что ECV не изменилась через 6 месяцев после AVR, тогда как наблюдался значительный регресс клеточной гипертрофии [86]. Однако нет данных CMR относительно позднего регресса показателей диффузного фиброза. Мы считаем, что использование объема фиброза в качестве меры абсолютного фиброза может лучше отражать прогрессирование заболевания и иметь возможность отслеживать изменения при интервальных сканированиях, хотя это требует исследования в проспективных исследованиях.
Аортальный стеноз — это прогрессирующее заболевание на основе сужения площади отверстия АоКл (в норме 3-4 см2).
В большинстве случаев причина стеноза АоКл — пассивная кальцификация створок, средний возраст больных 75 лет.
Ревматическая атака (Streptococcus группы А) может случится в любом возрасте, характерна лихорадка и поражение нескольких клапанов.
Люди с двустворчатым АоКл (1-2% в популяции) имеют повышенный риск развития стеноза в возрасте 60 лет. Так же повышен риск аневризмы и диссекции аорты, эндокардита.
Стеноз АоКл как правило бессимптомный, пока площадь отверстия >1 см2.
В начальной стадии возрастает сопротивление потоку и давление в ЛЖ, ударный объем снижается.
Из-за перегрузки давлением компенсаторно развивается гипертрофия ЛЖ за счет параллельного нарастания саркомеров миоцитов.
Это позволит усилить давление и вернуть ударный объем в норму.
Постепенно нарушается коронарный кровоток и системное кровообращение.
Высокий риск аритмии и внезапной остановки сердца, плохой долгосрочный прогноз.
Стеноз бывает надклапанный, клапанный (наиболее часто), подклапанный.
Чтобы определить степень тяжести оценивают внешний вид, мобильность, градиент давления.
Максимальный градиент рассчитывают по уравнению Бернулли: PG = 4 x (Vmax)2 (норма <10, критический >70 мм рт ст).
Градиент очень зависит от функции желудочков, поэтому может вводить в заблуждение.
Площадь отверстия в норме 2,5-5,5 см2, критический стеноз <0,92 см2.
Безразмерный индекс тяжести = отношение скорости LVOT / скорости АоКл.
Индекс <0,25 подразумевает площадь клапана 0,75 см2 и тяжелый стеноз.
Осложнения: гипертрофия или расширение ЛЖ, систолическая и диастолическая дисфункция ЛЖ, постстенотическая дилатация.
Тяжелый АС определяется как скорость аортальной струи >4 м/с, средний чрезклапанный градиент давления >40 мм рт cт и расчетная AVA <1,0 см2.
Однако есть ситуации, в которых эти параметры не совпадают, что затрудняет диагностику тяжелой степени.
Пациенты с парадоксальным низким потоком и низким градиентом тяжелого АС имеют сохраненную ФВ ЛЖ, AVA <1,0 см2, средний градиент <40 мм рт ст, индекс ударного объема ЛЖ <35 мл/м2.
Состояние низкого кровотока определяется небольшой полостью ЛЖ из-за тяжелой гипертрофии ЛЖ.
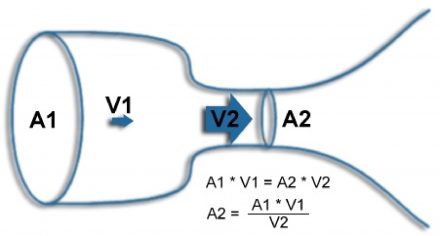
Уравнение целостности: стандартный метод расчета площади открытия клапана.
Систолические скорости в ЛЖ оценить на аортальном клапане и область LVOT.
A2 = область стеноза аорты, V2 = интеграл скорости стеноза аорты во времени (VTI, полученный с помощью CW-Doppler), A1 = область LVOT и V1 = LVOT VTI (полученный с PW-Doppler).
Ошибками при оценке тяжелого стеноза аорты являются: стеноз аорты с низким выходом и низким градиентом и стеноз точечного отверстия.
Обследование стеноза АоКл считается неполным, если максимальные скорости не задокументированы с правой парастернальной точки (пациент лежит на правом боку).
Рисунок. У пациента с протезом АоКл спустя 12 лет появились жалобы на одышку и боль в груди. Окно 1 неподходящее (нет ЦДК сигнала в круге): максимальная скорость потока 3,3 м/с; в окне 2 лучшая визуализация (ЦДК сигнал в круге) максимальная скорость потока 3,8 м/с; из надгрудинного доступа в положении на правом боку максимальная скоростью потока 4,3 м/с. Этот случай демонстрирует важность использования всех доступных Эхо-КГ окон для оценки функции клапана.
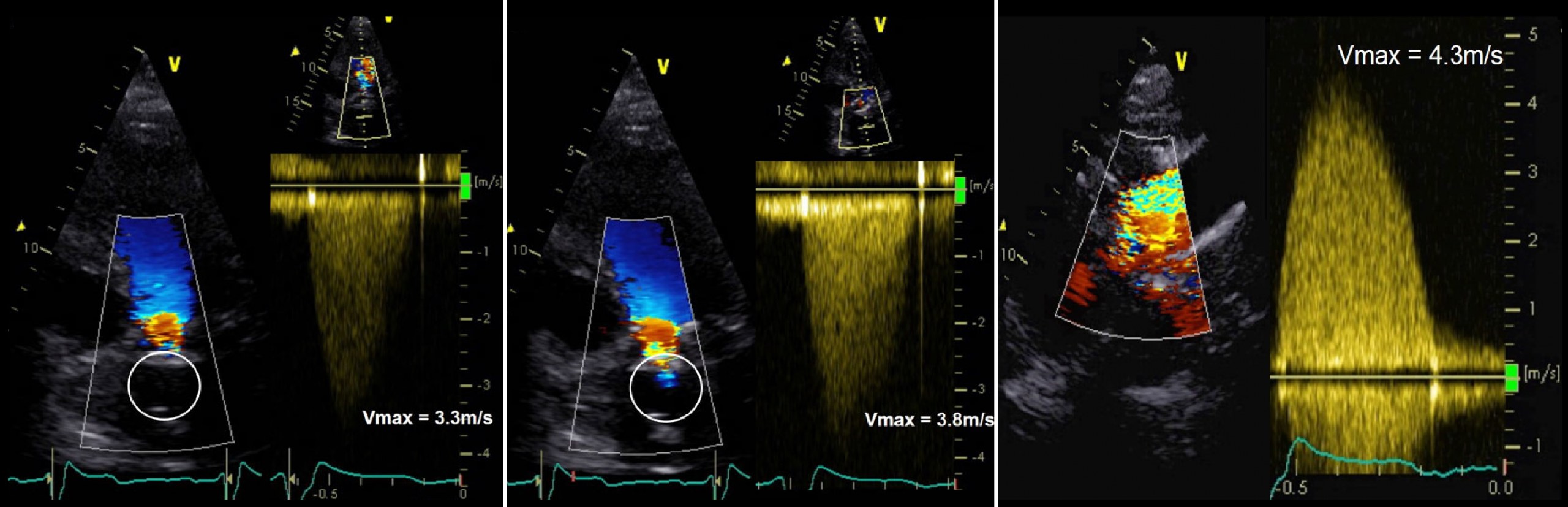
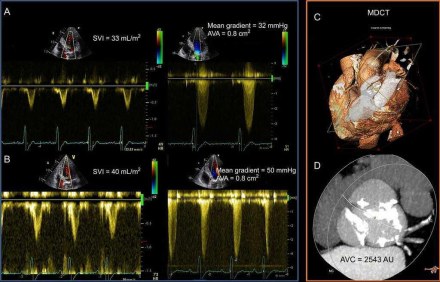
Рисунок. A: Эхо-КГ выявила противоречивые показатели степени тяжести стеноза АоКл — средний градиент 32 мм рт ст, площадь отверстия 0,8 см2, индекс ударного объема 33 мл/м2. B: Стресс-Эхо-КГ с низкой дозой добутамина увеличила средний градиент до 50 мм рт ст, площадь отверстия осталась 0,8 см2, индекс ударного объема увеличился на 21%. Это указывает на тяжелый стеноз АоКл с низким потоком и низким градиентом, а также наличие резерва кровотока (индекс ударного объема увеличился >20%). C: Многорядная КТ сердца с визуализацией объема с плоскостью, пересекающей кольцо аорты. D: Кальцификации АоКл по методу Агатстона 2543 AU, что указывает на тяжелый стеноз (пороговые значения для тяжелого АС = 2065 AU у мужчин и = 1274 AU у женщин). AVA, область аортального клапана; AVC, кальцификация аортального клапана; MDCT — многодетекторная строчная КТ; SVI — индекс ударного объема.
Недостаточность АоКл
Аортальная регургитация (АР) часто встречается при кальцинировании аортального клапана, но также может быть вызвана другой патологией, поражающей клапан, такой как эндокардит или корень аорты, вызывающей функциональную регургитацию, как при гипертонии, синдроме Марфана, аннулоаортальной эктазии, коллагеновых сосудах. заболевание и расслоение аорты.
Точно так же при аортальной регургитации левый желудочек расширяется в ответ на хроническую перегрузку объемом в виде эксцентрической гипертрофической реакции. Со временем также происходит декомпенсация этой реакции ремоделирования, приводящая к сердечной недостаточности, появлению симптомов и побочных эффектов при отсутствии лечения. Текущие рекомендации рекомендуют замену клапана при наличии тяжелой аортальной регургитации и симптомов или когда дилатация ЛЖ достигает определенных пороговых значений.
